-
1 知识点
-
2 课件
-
3 课堂练习
-
4 课后巩固
化学消毒法主要是通过向水中投加化学药剂,对水中微生物进行氧化灭活的消毒方法,常用的化学氧化方法有氯氧化法、臭氧氧化法、二氧化氯氧化法等。
8.1.1氯化法消毒
氯化法常采用的氯化消毒剂为液氯、漂白粉、氯片等。这些氯化消毒剂消毒原理基本相同,依靠水解产生的次氯酸进行氧化,所以将其统称为氯系消毒剂。
一、氯的性质及消毒作用
氯有很强的氧化能力,是工业上使用的主要消毒剂,通常以液氯形式提供,便于运输和贮存。在气态时呈黄绿色,约为空气重的2.48倍。液氯为琥珀色,约为水重的1.44倍。氯有刺激性臭味、有毒,当空气中氯气浓度达40~60mg/L,呼吸0.5~1h即有危险。
氯投入水中之后会发生水解,并和污水中的组分发生反应。
1.氯与水的反应
氯微溶于水,10℃时最大溶解度约为1%,当水中加入氯后即发生水解反应,如式8-1所示。
Cl2+H2O→HClO+H++Cl- (式8-1)
反应在几分钟之内就可以完成,生成的次氯酸是一种弱酸,又进而在水中继续离解,生成H+、ClO-,并达到平衡,反应如式8-1所示。
HClO→H++ClO- (式8-2)
其电离常数为:![]() ,式两边取对数可得
,式两边取对数可得![]() ,可见加氯之后水中HClO和ClO-所占比例随水温及pH值得变化而变化,其关系如图8-1所示。
,可见加氯之后水中HClO和ClO-所占比例随水温及pH值得变化而变化,其关系如图8-1所示。
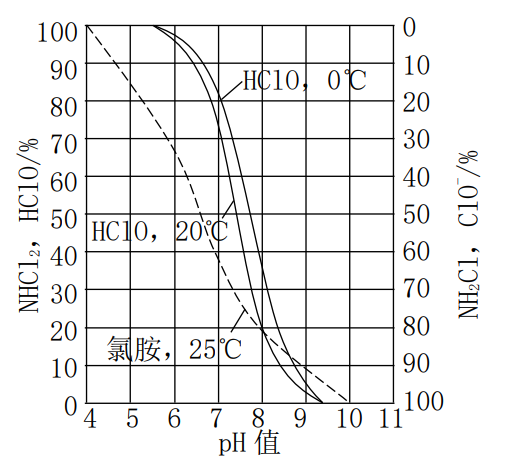
图8-1 HClO、ClO-、氯胺占比与pH关系
Cl2、HClO和ClO-均具有氧化能力,但HClO得杀菌能力要强于ClO-,大约高出70~80倍以上,这是因为HClO为中性分子,可以扩撒到带负电的细菌表面,并穿过细胞膜渗入细菌体内,破坏菌体内的酶而使细菌灭活。ClO-带负电,虽然其氧化作用也很强,但是难以靠近菌体,所以灭活作用有限。由于在氯系消毒溶液中主要起氧化作用的是Cl2、HClO和ClO-,所以通常把Cl2、HClO和ClO-形式存在于水中的氯为游离有效氯。
2.氯与氨的反应
氯和次氯酸不仅能与细菌作用,杀死细菌,也能与存在于水中的多种物质作用,当水中有氨存在时,氯和次氯酸容易与氨化合生成各种氯胺,反应如下式所示:
NH3+HClO=H2O+NH2Cl
NH3+2HClO=2H2O+NHCl2
NH3+3HClO=3H2O+NCl3
NH2Cl、NHCl2和NCl3分别称为一氯胺、二氯胺和三氯胺,各种氯胺所占比例与水的pH值和温度有关,如图8-1所示。从图中可知,当水的pH值在5~8.5之间时,NH2Cl和NHCl2同时存在,但pH值很低时NHCl2较多,NCl3在pH值低于4.4时才产生,一般生活污水和给水处理中不大可能出现。通常NHCl2的杀菌能力比NH2Cl强,因此从生成氯胺的角度来看,保持相对较低的pH值也是有利于消毒的。
从消毒的效果来看次氯酸是强于氯胺的,但是氯胺能够通过缓慢水解生成次氯酸,使得消毒具有一定的持续性,所以通常将氯胺称为化合有效氯。
3.氯与其他其他杂质的作用
氯还可以与水中其他杂质发生反应,特别是还原性物质,如Fe2+、Mn2+、NO2-、S2-等都是水中可能存在的,尤其是在污水的消毒处理过程中,可能会消耗一部分有效氯。
二、加氯量的确定
氯化法消毒所需要的加氯量,应满足两个方面要求:一是在规定的反应终了时,应达到指定的消毒指标;二是出水保持一定的剩余氯,以确保在给水时管网中的微生物难以繁殖。因此用于污水或给水消毒的加氯量应是需氧量和余氯量之和,污水或给水消毒的加氯量应通过试验确定。
1.余氯种类和余氯量
在使用氯氧化消毒时,消毒效果和氯的剂量、接触时间密切相关。在给定的消毒效果下,接触时间越长,低剂量的氯就可以了,但是缩短接触时间,就需要增加氯的剂量。此外消毒效果还和有效氯的种类有关,通常把Cl2、HClO、ClO-称为游离性余氯(自由性余氯),把氯胺及其化合物称为化和性余氯。两者之和就是总余氯。
氯化消毒后,余氯应根据水处理的目的和性质确定,如中国生活饮用水卫生标准规定,加氯接触30min后,游离性余氯不应低于0.3mg/L,管网末梢水的游离性余氯不应低于0.05mg/L;对于各种污水的氯氧化消毒,也有相应的余氯量指标限值要求,如含氰污水的氯化处理要求水中余氯量为2~5mg/L。
2.加氯量
对污水和给水进行氯化消毒时,加氯量应该试验确定,具体方法是在相同水质的一组水样中分别投加不同剂量的氯,经过相同的接触时间(15~30min)后,测定水中的余氯量,以加氯量为横坐标,余氯量为纵坐标绘制曲线,得到余氯量与加氯量的关系曲线,即需氧量曲线,如图8-2所示。依据此曲线,并根据处理之后需要达到的余氯量即可确定投氯量。
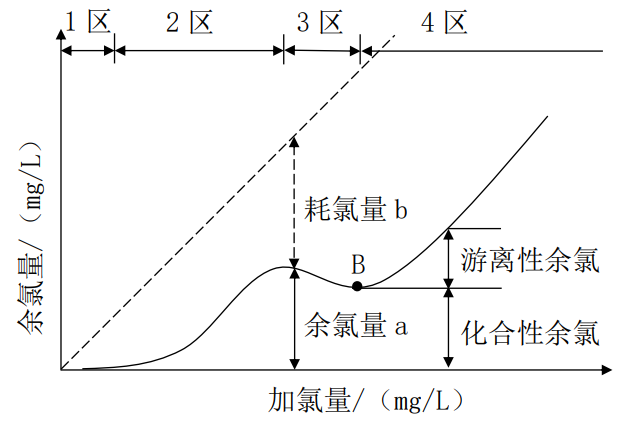
图8-2 需氧量曲线
图中虚线斜率为1,即余氯量等于加氯量,表示在纯水中无杂质,没有消耗氯。同一加氯量条件下,虚线和实现之间的纵坐标差b即为耗氧量,而实线上每一点的纵坐标a即为余氯量。不同水质的加氯需氧量曲线是不同的,但是基本上呈现出图8-2中的趋势,通常根据曲线规律的不同可以把需氧量曲线分为4个区。
你能根据对需氧量曲线进行分析吗?
根据上述分析可以知道经过加氯量试验,加氯量大于B点,才能保证消毒效果,所以这种方法也成为折点加氯法。
当无实测资料时,对于成分相对稳定的生活污水也可以采用经验数值:一级处理后的污水采用20~30mg/L,二级处理后的污水采用8~15mg/L;对一般的地表水(水源水)经过混凝沉淀或清洁的地下水,加氯量可采用1.0~1.5mg/L,一般地表水经混凝沉淀未经过滤时,可采用1.5~2.5mg/L。
三、加氯设备
加氯设备通常采用加氯机。国内最常使用的加氯机有转子加氯机和真空加氯机两种,图8-3为ZJ型转子加氯机。
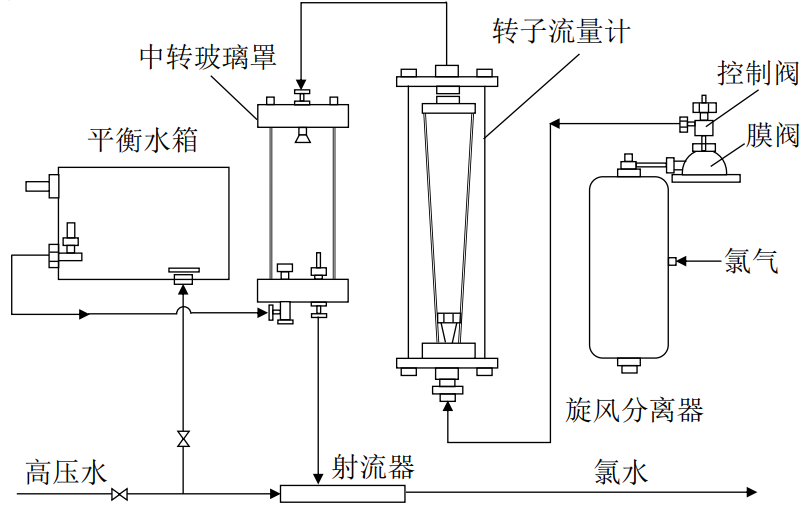
图8-3 ZJ型转子加氯机
其工作过程为:来自氯瓶的氯气经过旋风分离器,将氯气中的悬浮杂质(如铁锈、油污等)分离出来,减压阀——弹簧膜阀保证瓶内安全压力大于0.1MPa,如氯瓶压力小于0.1MPa则该膜阀关闭,起到稳压的作用。纯净的氯气通过控制阀进入转子流量器,通过转子流量器和控制阀可以准确控制流量。中转玻璃罩用于观察加氯机的工作情况和稳定加氯量,防止压力水倒吸和当水源中断时破坏罩内真空的作用。平衡水箱可以补充和稳定中转玻璃罩内水量,当水流中断时自动暴露单向阀口,吸入空气,破坏罩内真空。射流器则利用负压从中转玻璃罩内抽吸所需的氯,并与水混合。
四、氯化法消毒特点
氯化法消毒由于效果可靠、成本低,设备相对简单而被广泛应用于给水和排水处理,但是由于其容易与水中的有机物形成致癌前驱体、余氯对生物有危害等问题,在某些对水质有较高要求的场合并不适合。
五、氯化法消毒副产物及控制
消毒副产物是指在污水的消毒过程中,由于消毒剂与污水中的成分发生化学反应所形成的有害物质。
1.氯化法消毒副产物
氯化法消毒最常见的副产物时三卤甲烷和卤乙烷,是由于游离氯和腐殖酸之间一系列的反应产生,可以对液氯消毒后出水进行后处理脱氯。
2.消毒后余氯的去除
低度余氯可能会对水生生物有潜在毒害效应,因此在对出水水质要求较高的场合或考虑到环境影响的消除应该对余氯进行去除。脱氯方法有二氧化硫脱氯、亚硫酸盐脱氯、硫代硫酸钠脱氯、活性炭脱氯等。
(1)二氧化硫脱氯
二氧化硫脱氯是目前最常用的去除余氯的方法。当二氧化硫投入水中时,生成的亚硫酸(H2SO3)是一种强还原剂,亚硫酸在水中又会解离成HSO3-,它与游离氯及结合氯作用,生成氯化物和硫酸盐离子。
由于二氧化硫与氯和氯胺的反应通常很快,所以接触时间短,不需要使用接触池,在投加点处进行快速而有效的搅拌即可。但是余氯的监测装置必须有足够的精度,避免投入过量的二氧化硫,过量的二氧化硫不仅会造成浪费,还会导致测得的出水BOD5和COD值增加(溶解氧被还原),此外pH值还可能会降低。
(2)活性炭脱氯
活性炭脱氯可以将游离有效氯和化合有效氯都脱除,主要依靠碳的还原,以与Cl2反应为例,其主要反应如下:
C+2Cl2+2H2O→4HCl+CO2
在利用粒状活性炭去除有机物的污水处理厂中,可利用同一炭床进行脱氯。
8.1.2臭氧消毒
在化学氧化法部分已经介绍过臭氧也具有很强的氧化能力,约是氯的两倍。因此,臭氧的消毒能力要强于氯。臭氧消毒最早多用于给水处理,但随着臭氧制备和溶液技术的进展使得臭氧用于污水消毒在经济上渐渐具备竞争力。
一、臭氧接触池
进行臭氧消毒时,无论是进行纯氧制备还是空气制备的臭氧,其含量都不高,进入液相的传输效率直接成为其经济上重要的考虑因素。因此通常采用深而有盖的接触池,提高其传输效率,从而降低臭氧的消耗量,节约成本。图8-3为典型的臭氧消毒系统流程图。
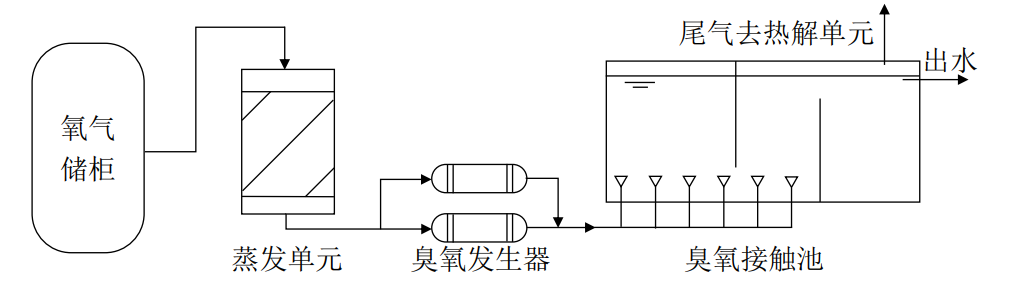
图8-3 臭氧接触法流程
臭氧用多孔扩散器或注射器油接触池第一反应室引入,发生快速的臭氧反应,然后污水与臭氧混合液进入第二反应室进行较为缓慢的反应,主要的消毒反应在第二室中进行。第三室用于剩余臭氧的缓慢消毒和臭氧分解。
臭氧消毒的尾气需要处理后才能排放,如使用纯氧制备臭氧,则其尾气为高纯度氧气,可以回收利用。
二、副产物的形成和控制
1.臭氧消毒形成的副产物
臭氧消毒不会产生氯化副产物,但是臭氧消毒也会产生醛类、各种酸、醛酸和酮酸等副产物,当有溴化物存在时也能会产生无机溴盐离子、溴仿、溴化乙腈等,有时也会产生过氧化氢。
2.对臭氧消毒副产物的控制
因为非溴化副产物一般易于生物降解,所以处理后的水通过生物活性滤器或炭柱就可以去除,也可使用其他生物法或土地处理法与以去除。溴化副产物带来的问题比较严重,应考虑采用紫外照射去除。
三、臭氧消毒法的特点
臭氧本身有生物毒性,但由于其不稳定,易于分解,所以当出水流入受纳水体时,一般没有剩余臭氧。此外臭氧消毒效果可靠、有助于提高水体溶解氧含量、处理后无残留物质需要去除。但是臭氧需要现场制备,费用较高,所以常用于对水质有较高要求的场合。
8.1.3二氧化氯消毒
二氧化氯(ClO2)是一种杀菌剂,它消毒能力与氯相当或更强,对于病毒灭活有效性高于氯。这主要是因为二氧化氯易被胨(一种蛋白质)吸附,而胨是病毒蛋白质外壳的一层膜,通过吸附并破坏病毒蛋白质外壳,造成病毒的灭活。二氧化氯本质上也是一种氯消毒,但是它与通常的氯消毒不同,一般只起氧化作用,不起氯化作用。
一、二氧化氯的特性
二氧化氯在常温常压条件下,为一种黄红色有刺激性异味的不稳定气体,密度较大。由于二氧化氯不稳定,易分解,通常也需要现场临用配制。通常采用氯的水溶液与次氯酸钠溶液混合并反应,反应如式8-3所示。
2NaClO2+Cl2→2ClO2+2NaCl (式8-3)
二、二氧化氯消毒机理
二氧化氯具有很高的氧化势,杀菌能力强,其杀菌机理可能包括关键酶系统的灭活或蛋白质的破坏。其对细菌的灭活机理与氯化法相似,但对于病毒的消毒则有较大不同。总体来说二氧化氯的消毒有效性基本与游离有效氯相同。
二氧化氯对经水传播的病原微生物均有较好的效果,对病毒、孢子、蠕虫、水虱的杀灭效果要优于液氯。在饮用水的处理中对肠道病原菌杀灭作用十分有效,可用于医院污水的杀菌、消毒。一般处理中二氧化氯投加量为30mg/L,二级处理投加量为15mg/L,同时二氧化氯也可以用来净化空气。
三、副产物和环境影响
采用二氧化氯消毒时主要的副产物为次氯酸盐和氯酸盐,两者都存在潜在的毒性,其中次氯酸盐主要来自于二氧化氯的制备过程,一级二氧化氯的还原作用。二氧化氯副产物的分解比余氯消毒副产物快,因此对水生生物的危害没有余氯消毒严重。
次氯酸盐的形成可以通过制备环节严格管理原料或加大投氯量来减少,或采用二氧化硫、亚铁或亚硫酸盐法去除。二氧化硫去除二氧化氯发生的反应如下式所示:
SO2+H2O→H2SO3
5H2SO3+2ClO2+H2O→5H2SO4+2HCl



