-
1 知识点
-
2 课件
-
3 课堂练习
-
4 课后巩固
化学沉淀法是指向被处理的水中投加化学药剂(沉淀剂),使之与水中溶解态的污染物直接发生化学反应,形成难溶的固体沉淀物,再进行固液分离,从而从水中去除污染物的方法。对于危害性极大的重金属盐类,化学沉淀法仍是目前最为重要的方法。
化学沉淀法的工艺过程通常包括三个步骤:1投机化学沉淀剂,与水中污染物反应,生成难溶的沉淀物析出;2通过凝聚、沉降、气浮、过滤、离心等方法进行固液分离;3泥渣的处理或回收利用。
4.1.1化学沉淀法的基本原理
水中难溶盐服从溶度积原则,即在一定温度下,在含有难溶盐AmBn(固体)的饱和溶液中,各种离子浓度的乘积为一常数,称为溶度积常数,记为Ksp:
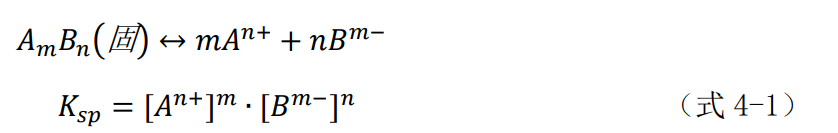
式中:An+表示金属阳离子;Nm-表示阴离子;[]表示物质的量浓度,mol/L。
上式对各种难溶盐都应成立。所以当溶液中[An+]m·[Bm-]n>Ksp时,溶液过饱和,超过的那部分盐将析出沉淀,直到符合式4-1为止。相反的,如果[An+]m·[Bm-]n<Ksp,溶液不饱和,难溶盐将溶解,直至符合式4-1为止。这是简化了的理想状态,在实际中受很多因素影响情况要复杂得多,但它仍有实际的指导意义,可以用来判断和优化化学沉淀条件。
你能根据化学反应平衡的移动,完成下列关于式4-1化学沉淀条件的判断吗?
难溶物的Ksp是必要的参数,可以从化学手册中查到(见表4-1)。

4.1.2氢氧化物沉淀法
除了碱金属和部分碱土金属外,其他金属的氢氧化物大多是难溶的。由表4-1可以看出大多数的金属氢氧化物的溶度积一般都很小,因此可以用氢氧化物沉淀法去除水中的重金属离子。沉淀剂为各种碱性药剂,常用的有石灰、碳酸钠、氢氧化钠、石灰石等。
水中金属离子很容易生成各种氢氧化物,其中包括氢氧化物沉淀和各种羟基配合物,它们的生成条件和存在状态与溶液pH密切相关。只有在各自对应pH值范围内进行化学沉淀,才能保证金属氢氧化物沉淀的析出。
以Mn+表示金属离子,则其氢氧化物的溶解平衡如式4-2所示。
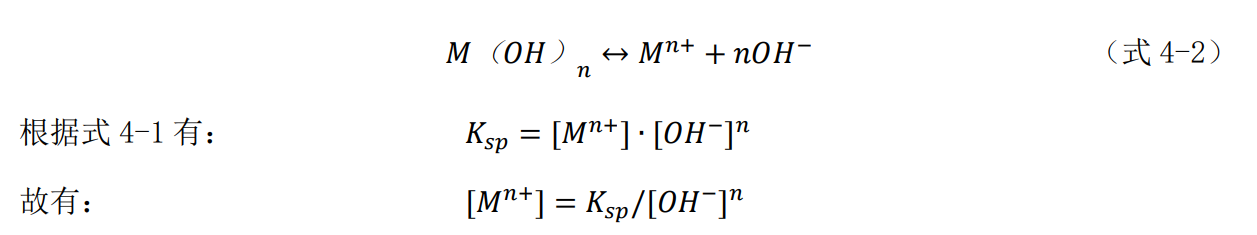
这里的[Mn+]是溶液在任意pH值条件下,可以存在的金属离子Mn+的最大浓度。
因为25℃时水的离子积为: Kw=[H+][OH-]=1×10-14
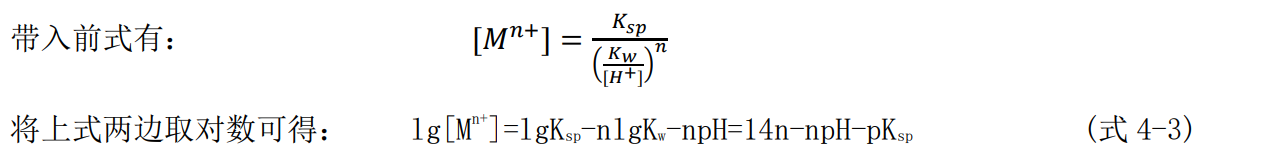
根据式4-3完成以下结论:
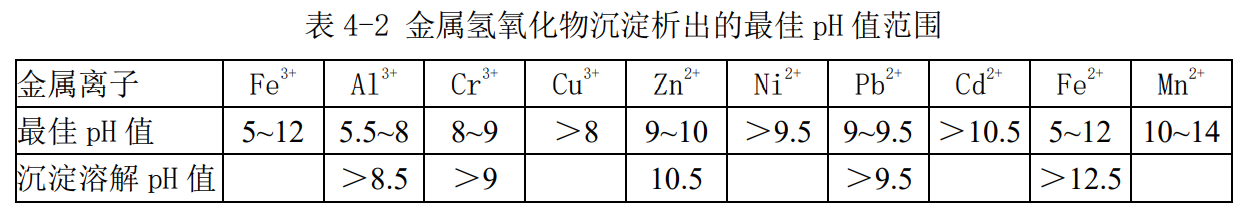
由于实际污水水质复杂,干扰因素很多,上述理论计算结果与实际由出入,因此实际操作时应通过对待处理污水进行试验来确定最适pH值范围。表4-2给出了一些金属氢氧化物沉淀析出的最佳pH值范围。
当污水中存在CN-、NH3、S2-、及Cl-等配位体时,能与金属离子结合生成可溶性配合物,增加金属氢氧化物的溶解度,对沉淀不利,应通过预处理去除。
此外,Zn、Pb、Cr、Al等的氢氧化物为两性化合物,它们既可以在酸性溶液中溶解,也可以在碱性溶液中溶解,因此只有在一定的pH值范围内才是沉淀。
氢氧化物沉淀法适用于不准备回收的低浓度金属废水(如Cd2+、Zn2+等)的处理。
4.1.3硫化物沉淀法
金属硫化物是比氢氧化物更难溶的沉淀物,对去除水中重金属离子(如Hg2+、Ag+等)由更好的效果,且消耗的试剂量相当少,因此能大规模应用。常用的沉淀剂有:H2S、NaHS、Na2S、(NH4)2S等,同时根据沉淀转化原理难溶硫化物MnS、FeS也可作为处理药剂。
硫化物沉淀法处理含重金属离子污水,具有去除效率高、可分步沉淀、泥渣中重金属含量高、适应pH值范围广等优点,在某些领域得到了实际应用。但由于反应产生的硫化物沉淀颗粒细小,沉淀困难,处理费用高;S2-可使水体中COD增加;会产生硫化氢污染大气(当水体酸性增加时),因此限制了其推广使用,一般仅作为氢氧化物沉淀法的补充。
4.1.4钡盐沉淀法
钡盐沉淀法主要应用与含Cr6+污水的处理。采用的沉淀剂有BaCO3、BaCl2、BaS等,生成铬酸钡(BaCrO4),其溶度积Ksp=1.2×10-10。以BaCO3为例,它与废水中铬酸根进行反应如下式所示:
![]()
钡盐法处理含铬污水时要准确控制pH值,pH值越低,BaCrO4溶解度越大,对去除Cr6+不利;但pH值太高,CO2气体难以析出,也不利于除铬反应的进行。一般采用BaCO3作为沉淀剂时,用硫酸或乙酸调节pH值范围在4.5~5之间,反应速度快,去除效果好,药剂用量少。一般不使用HCl作为pH调节剂,避免其残留氯带来不利影响。采用BaCl2作为沉淀剂时,生成的HCl会使pH值降低,此时pH值应控制得高一些(6.5~7.5)。
为了促进沉淀的进行,通常向水中加入过量的沉淀剂,导致出水中含有过量的钡,因此不能直接排放,出水应该通过一个以石膏碎块为滤料的滤池,使得过量得钡与石膏生成硫酸钡沉淀(石膏法),与水分离,反应如下式所示:

![]()
钡盐法形成的沉渣中主要含铬酸钡,可以加以回收利用。方法之一式向沉渣中投加硝酸和硫酸,投加比例约为沉渣:硝酸:硫酸=1:0.3:0.08(质量比)。反应产物由硫酸钡和铬酸,可以分别回收利用。钡盐沉淀法处理后水清澈透明,可用于生产,但碳酸钡来源少,且容易引入二次污染物Ba2+,处理过程对条件控制要求较高。
4.1.5碳酸盐沉淀法
碳酸盐沉淀法是通过向水中投加某种沉淀剂,使其与金属离子生成碳酸盐沉淀法的方法。碳酸盐沉淀法有三种不同的应用方式,适用于不同的处理对象:1投加难溶碳酸盐(如碳酸钙),利用沉淀转化原理,使水中金属离子(如Pb2+、Cd2+、Zn2+、Ni2+等)生成溶解度更小的碳酸盐而析出;2投加可溶性碳酸盐(如碳酸钠),使水中金属离子生成难溶碳酸盐而沉淀析出,这种方式可以去除水中的重金属离子和非碳酸盐硬度;3投加石灰,与水中碳酸盐硬度生成难溶的碳酸钙和氢氧化镁而析出,这种方法可以去除水中的碳酸盐硬度,下面分别用实例进行说明。
1.难溶性碳酸盐作为沉淀剂除铅
对于低浓度含铅污水中(如可溶性铅为0.1mg/L)可采用白云石过滤含铅废水,可以使溶解的铅变为碳酸铅沉淀,而后从水中去除。
2.可溶性碳酸盐作为沉淀剂除铜
用化学沉淀法处理含铜废水时,可采用碳酸钠作为沉淀剂,当污水pH值为碱性时,有如下化学反应,使铜离子生成难溶于水的碱式碳酸铜而从水中分离出来。
2Cu2++CO32-+2OH-→Cu2(OH)2CO3↓
3.石灰软化
软化是指去除或降低水中Ca2+、Mg2+等离子硬度的水处理技术。软化技术有化学软化法、离子交换软化等,其中化学软化法就是使用碳酸盐沉淀法去除或降低水中硬度。当原水中非碳酸盐硬度较小时,可采用石灰软化法处理,主要发生的反应如下:
Ca(OH)2+CO2→CaCO3↓+H2O
Ca(OH)2+Ca(HCO3)2→2CaCO3+2H2O
Ca(OH)2+Mg(HCO3)2→CaCO3↓+MgCO3↓+2H2O
Ca(OH)2+MgCO3→CaCO3↓+Mg(OH)2↓
对于含非碳酸盐硬度较高的水可采用石灰-纯碱软化法处理;当原水碱度较大(大于硬度)时,水中无非碳酸盐硬度存在,而有NaHCO3存在,对于这种水,采用石灰-石膏(或CaCl2)法处理。
4.1.6铁氧体沉淀法
铁氧体一般是指铁族元素和其他一种或多种金属元素的复合氧化物,它具有高磁导率和高电阻率,是一种重要的磁性物质。铁氧体不溶于酸、碱、盐溶液,也不溶于水,其一般由二价金属氧化物和三价金属氧化物构成,可用通式BO·A2O3表示,其中B代表二价金属,如Fe、Mg、Zn、Mn、Co、Cu、Ni等,A代表三价金属,如Fe、Al、Cr、Bi等。最常见的铁氧体为磁性氧化铁Fe3O4(FeO和Fe2O3的混合物)。
铁氧体沉淀法是20世纪70年代发展起来的技术,主要用于处理含重金属离子的污水,其基本原理是通过向污水中投加铁盐,通过控制工艺条件使废水中的重金属离子与铁盐生成稳定的铁氧体共沉淀,然后采用固液分离技术使沉淀与水分离,从而达到去除水中重金属离子的目的。
铁氧法沉淀工艺包括投加亚铁盐、调节pH值、充氧加热、固液分离、沉渣处理这五个环节。
1.投加亚铁盐:为了形成铁氧体,需要有足量的Fe2+及Fe3+。投加亚铁盐的作用有三:补充Fe2+;通过氧化,提供Fe3+;若水中有Cr6+,可以被Fe3+还原为Cr3+,成为铁氧体原料。
2.调节pH值:一般调整污水的pH值为8~9范围内,以使大多数金属氢氧化物沉淀物能沉淀析出。
3.充氧加热:通常向水中通入空气,使Fe2+转化为Fe3+;同时通过加热促进铁氧体的形成。
4.固液分离: 可采用沉淀法、离心法或磁力分离法进行固液分离。
5.沉渣处理:按沉渣的组成、性质和用途不同,处理方式各异。若污水成分单一,浓度稳定,则沉渣可以作为铁氧体磁铁的原料,应用于半导体领域。若污水成分复杂,则沉渣可供制耐蚀瓷器。
4.1.7设备和装置
采用化学沉淀法处理污水(主要是工业废水)时,由于产生的沉淀物往往不会形成带电荷的胶体,所以沉淀过程较为简单,一般采用普通的平流式沉淀池或竖流式沉淀池即可。具体的停留时间应该通过小试试验确定,一般情况下比生活污水或有机废水处理中的沉淀时间要短。
当使用的沉淀剂不同时,所需的投药及反应装置也不相同,比如有些处理药剂采用干投法,有些采用湿投法,都可以参考中和法中药剂投加的装置和设备,本章不再详细介绍。需要注意的是,有些沉淀剂的腐蚀性较强,需要充分考虑装置和设备的防腐蚀处理。



