把“分子间力”(范德华力)概念推广到离子-离子之间:
阳离子 - 阴离子: 静电引力 +范德华力

一、离子极化作用
离子极化作用(教材P.220图9-18)
离子极化力 (Polarizing主动)
离子变形性 ( Polarizability, Polarized 被动)
在异号离子电场作用下,离子的电子云发生变形,正、负电荷重心分离,产生“诱导偶极”,这个过程称为“离子极化”。
阳离子、阴离子既有极化力,又有变形性。
通常阳离子半径小,电场强,“极化力”显著。
阴离子半径大,电子云易变形,“变形性”显著。
(一)影响离子极化的因素
1. 离子电荷Z;
2. 离子半径r;
3. 离子的电子构型。
离子极化力:用“离子势”f或“有效离子势”f*衡量,
f(f*)↑,极化力↑
f = Z / r2 (主要用于s 区,p 区)
f*= Z*/ r 2(主要用于d 区、ds 区)
式中Z 为离子电荷(绝对值),Z*为有效核电荷,
r为离子半径(pm),常用L. Pauling 半径。
f = Z/ r2
可见左→右,Z↑ ,r↓ ,f↑, 阳离了极化力↑.
过渡金属元素:考虑外层电子构型影响,“有效离子势” f*衡量极化力更好:
f*= Z* / r2
Z*为有效核电荷。
离子电荷相同,半径相近时,电子构型对极化力的影响:
极化力:18e, (18+2)e ,2e >(9 – 17) e>8 e

原因:d 电子云“发散”,对核电荷屏蔽不完全,使Z *↑,对异号离子极化作用↑。考虑d 区,ds区离子极化力时,用Φ*↑更恰当。
(二)影响离子变形性因素
3个因素: 离子电荷、离子半径、外层电子构型。
用极化率a表示变形性, a↑,变形性↑
1. 阴离子
(1)简单阴离子:
外层电子构型相同:半径↑,负电荷↑,则a↑,变形性↑。
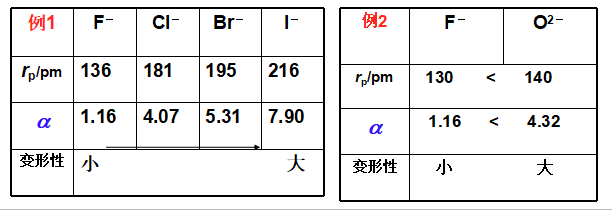
(2)复杂阴离子
变形性不大,且中心原子氧化数↑,该复杂离子变形性↓。 常见阴离子变形性顺序:
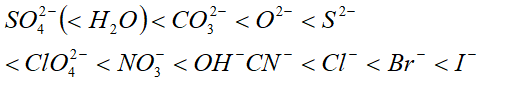
2. 阳离子变形性
(1)外层电子构型相同:Z ­, 变形性¯
8e 外层阳离子;

(2)外层电子构型相同,Z 相同,则r ­,变形性­
Na+< K+< Rb+< Cs+
Mg2+ <Ca2+< Sr2+< Ba2+
(3)Z相同,r相近,电子构型影响:
例1 Cd2+ > Ca2+
rp/pm 97 99
电子构型18e 8e
例2 Ag+ > K+
rp/pm 126 133
电子构型18e 8e
离子变形性小结
1.最易变形的是体积大的简单阴离子,如I-,S2-,以及不规则外壳[8e, (18 + 2)e和( 9 - 17)e],而又低电荷的阳离子,如Ag+、Hg2+、Cu+、Cd2+、Pb2+、Sn2+。
2. 最不易变形的是半径小,电荷高,8e或2e构型的阳离子,如Al3+、Be2+。
二、附加极化作用(互相极化作用)

例1:
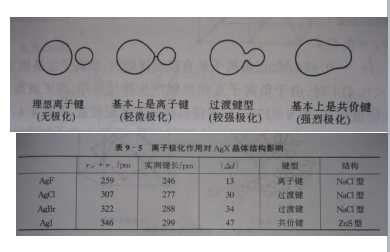
AgF白, 可溶;
AgCl白, 不溶;
AgBr浅黄白, 不溶;
AgI浅黄, 不溶。
H2O 极性分子,“相似相溶”.
正、负离子互极化作用↑键共价性↑ 颜色加深。
p220,图9-18,表9-5

例3.对晶体构型影响

三、离子极化理论优、缺点
首先把一切化学结合视为正、负离子的结合,然后从离子的电荷、半径、电子构型出发,判断出正、负离子互相作用情况,并借此说明有关化合物的化学键型、晶体类型、水溶度、颜色、水解能力、酸碱性的变化等, 是离子键理论的重要补充。
但离子化合物仅是化合物的一部分,故“离子极化学说”局限性较大。
本章小结
晶体划分为7个晶系、14种晶格(点阵)。
一. 金属晶体
1.堆积方式
简单立方 A·A
体心立方 AB·AB(A正方形,B 1个原子)
面心立方 ABC·ABC
六方密堆 AB·AB(A六角形,B三角形)(但不同于体心立方堆积的正方形)
2.空间利用率计算
二. 离子晶体
1.常见类型:
CsCl、NaCl、立方ZnS、荧石CaF2、金红石TiO2型。
要求掌握NaCl、CsCl型。
2.半径比规则:(经验规则)
r+/ r- <0.414
→ 立方 ZnS型晶体 (C.N. 4:4)
r+/ r- = 0.414 ~ 0.732
→ NaCl面心立方型晶体(C.N. 6:6)
r+/ r- >0.732
→ CsCl简单立方型晶体(C.N. 8:8)
例外:离子互相极化 → 键共价性 ↗
AgI(c) r+/ r - =0.583
预言:NaCl型
实际:立方ZnS型(C.N. ↘)
三.分子晶体
H2O, CO2,N2, O2,F2
四.原子晶体:
金刚石(C)、硅晶体、金刚砂(SiC)、石英(SiO2)
五.过渡型晶体
石墨(C)
石棉(Ca2SiO4主要成分)
六. 离子极化理论
离子极化力和离子变形性影响因素及对化合物性质(化学键型、晶体类型、水溶度、颜色、水解能力、酸碱性)的影响。


