按占据晶格结点在质点种类及质点互相间作用力划分为4类。(教材p.212, 图9-8)

一、金属晶体
表9-1 金属晶体的4种晶格(教材p.213 – 215)

(一)堆积方式
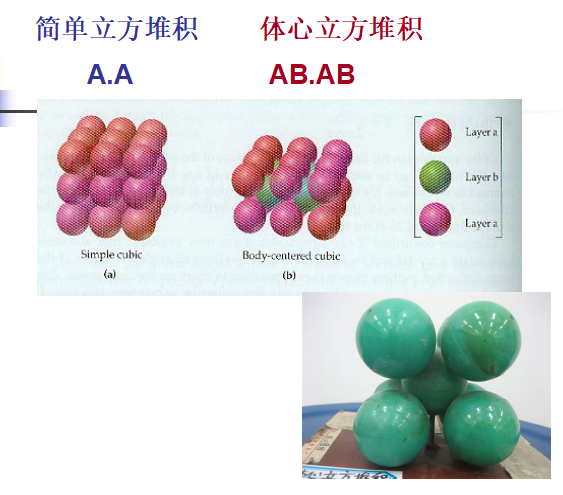
1. 简单立方堆积(simple cubic packing):A.A
2. 体心立方堆积(body-centered cubic packing): AB.AB
3. 面心立方密堆积(face-centered cubic packing):ABC.ABC
4. 六方密堆积(hexagonal close packing): AB.AB
(A层六角形, B层三角形,不同于体心立方堆积中的正方形)

六方密堆积:AB-AB排列堆积
A层六角形,B层三角形,不同于体心立方堆积中的正方形(教材p. 213, 图9-10)。
A层与B层之间存在两种类型的空隙,即四面体空隙及八面体空隙。

简单立方(左)和体心立方(右)解剖图
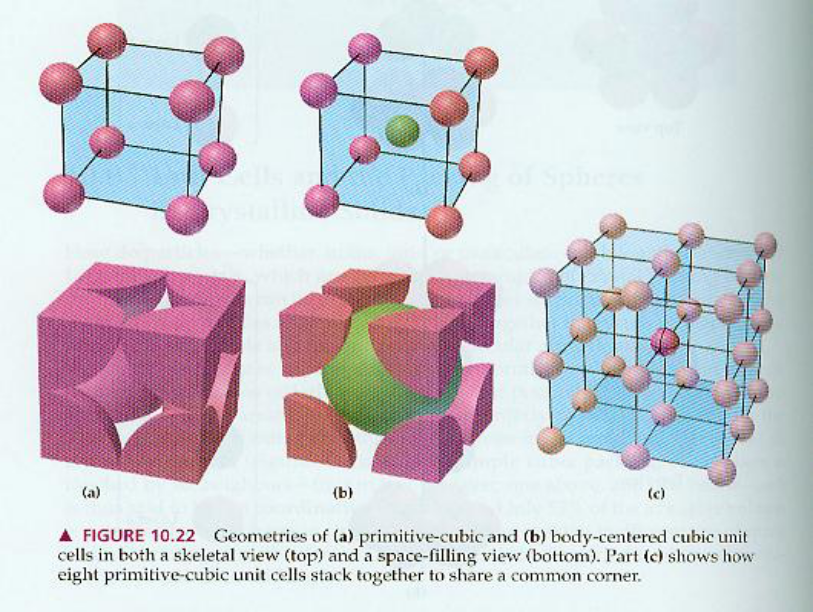
面心立方解剖图

(二)空间利用率计算
例2:(教材p.214,图9-12,9-13)

解:晶胞边长为d,原子半径为r.
据勾股定理:d 2+ d2 =(4r)2
d = 2.83 r
每个面心立方晶胞含原子数目:
8 ´ 1/8 + 6 ´ ½ = 4
a% = (4 ´ 4/3 pr3) / d3
= (4 ´ 4/3 pr3) / (2.83r )3 ´ 100%
= 74%
例2:体心立方晶胞中金属原子的空间利用率计算 (教材p.213, 图9-10)
空间利用率
a= 晶胞含有原子的体积 / 晶胞体积 ´100%
(1)计算每个晶胞含有几个原子:
1 + 8 ×1/8 = 2
(2)原子半径r与晶胞边长a的关系:
勾股定理:2a2 +a 2 = (4r) 2
底面对角线平方 垂直边长平方 斜边(体对角线)平方
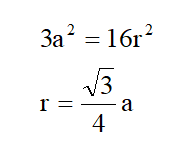
(3)空间利用率

(三)金属晶体特点
多数采面心立方或六方密堆积,配位数高(12)、熔、沸点高。
少数例外:Na、K、Hg。
二、离子晶体
(一)离子晶体的基本特征
1.占据晶格结点的质点:正、负离子;
质点间互相作用力:静电引力(离子键)
2.整个晶体的无限分子:
NaCl、CaF2 、KNO3…为最简式。
3.晶格能U↑,熔、沸点↑
U=[NAA Z+Z –e 2 (1 – 1/n)] / 4pe0r0
UµZ+Z–/r0
4.熔融或溶于水导电。
(二)5种最常见类型离子晶体的空间结构特征 (教材p. 218, 图9-15)


NaCl型:Cl-面心立方晶格,Na+占据八面体空隙

CsCl型:
Cl-简单立方晶格, Cs+占据立方晶体空隙

ZnS型:S2 面心立方晶格,
Zn2+占据1/2的四面体空隙

CaF2型:F 简单立方晶格,
Ca2+占据1/2的立方体空隙

TiO2型:
O2- 近似六方密堆积排列晶格(假六方密堆积), Ti4+占据1/2八面体空隙。
(O2- 蓝色,C.N. = 3; Ti4+ 浅灰色,C.N. = 6)

(三)半径比规则

 (四)半径比规则说明:
(四)半径比规则说明:
1. “半径比规则”把离子视为刚性球,适用于离子性很强的化合物,如NaCl、CsCl等。否则,误差大。
例:AgI(c) r + / r-= 0.583.
按半径比规则预言为NaCl型,实际为立方ZnS型。
因:Ag+ 与I-强烈互相极化,键共价性↑,晶型转为立方ZnS(C.N.变小,为4:4,而不是NaCl中的6:6)
2. 经验规则,例外不少。
例:RbCl(c),
预言CsCl型,实为NaCl型。
3. 半径比值位于“边界”位置附近时,相应化合物有2种构型。
例:GeO2 r+/ r -= 53 pm / 132 pm = 0.40.
立方ZnS
NaCl 两种晶体空间构型均存在.
4. 离子晶体空间构型除了与r +/ r -有关外,还与离子的电子构型、离子互相极化作用(如AgI)以至外部条件(如温度)等有关。
例: R.T. CsCl 属于CsCl类型;
高温 CsCl 转化NaCl型。
三、分子晶体
(一)占据晶体结点质点:分子
(二)各质点间作用力:范德华力(有的还有氢键,如H2O(s))
CH4晶体(右图).
(三)因范德华力和氢键作用比共价键能小,分子晶体熔点低、硬度小,不导电,是绝缘体。
(四)有小分子存在
实例: H2、O2、X2 ……
H2O、HX、CO2 ……
多数有机物晶体、蛋白质晶体、核酸晶体是分子晶体。

C60结构模型,其晶体是分子晶体;

C纳米管晶体结构图

四、原子晶体(共价晶体)
(一)占据晶格结点的质点:原子
(二)质点间互相作用力:共价健
熔沸点高,硬度大,延展性差。
(三)整个晶体为一大分子
(四)空间利用率低(共价健有方向性、饱和性)
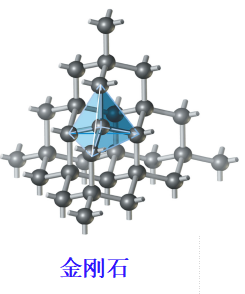
金刚石(C的C.N.= 4),空间利用率仅34%.
C 用sp3杂化,与另4个C形成共价单键,键能达400kJ•mol-1(教材p.222图9-20)
其他例子:GaN,InGaN(半导体),金刚砂(SiC),石英(SiO2)
沙子(SiO2原子晶体)和玻璃(无定形体)

五、混合型晶体(过渡型晶体)
例1:石墨(graphite)
C 单质

石墨晶体:层状结构
(教材p.224图9-22)

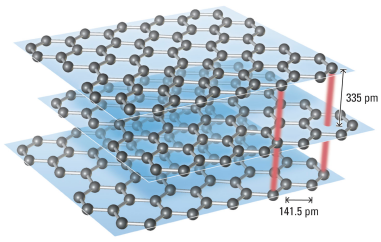
每层内:每个C作sp2杂化,与另3个C以共价键结合,并有离域p键(整层上、下)
层与层之间:以范德华力结合 ®过渡型晶体
导电率:沿层的方向高、垂直于层的方向低。
可作润滑剂。
石墨(上)和金刚石(下,原子晶体)晶体结构

例2: 石棉
Ca2SiO4为主要成分
Ca2+-SiO42-静电引力(离子键),
SiO42-四面体,Si-O共价健。
®离子晶体与原子晶体之间的过渡型晶体。



