沉淀生成的计算与应用
上一节
下一节
难容硫化物沉淀和溶解
例:向 0.10 mol·dm–3 FeCl2 溶液中通 H2S 气体至饱和(浓度约为 0.10 mol·dm–3 ) 时,溶液中刚好有FeS 沉淀生成,求此时溶液的 [H+] 。

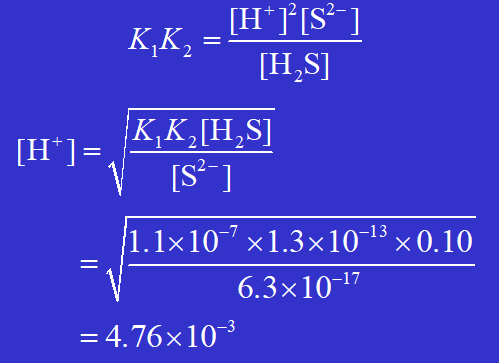
[H+] 较大,应是 FeCl2 溶液原有的。如果原来FeCl2 溶液的 [H+] 再大一些,那么即使 H2S 饱和也不会有 FeS 沉淀生成。
根据一些硫化物的溶度积常数,通过计算可得如下结论:若在一定浓度的盐酸中通入 H2S 气体,其中的Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、As3+、Sb3+ 和 Sn2+ 等离子将生成沉淀,而 Fe2+、Co2+、Ni2+、Zn2+ 和 Mn2+ 等离子继续保留在溶液中。
沉淀的转化
若难溶性强电解质解离生成的离子,与溶液中存在的另一种沉淀剂结合而生成一种新的沉淀,我们称该过程为沉淀的转化。
例: 0.20 dm3 1.5 mol·dm–3 的 Na2CO3 溶液可以使多少克 BaSO4 固体转化掉?
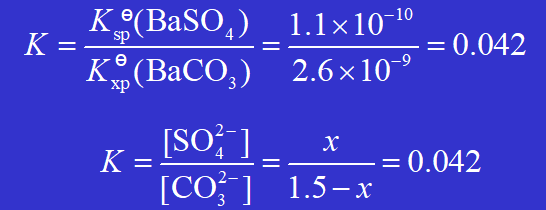
解得 x=0.060, 即 [ SO42-] =0.060 mol·dm–3
于是在 0.20 dm3 溶液中有 SO42– 1.2 × 10–2 mol
相当于有 1.2×10–2 mol 的 BaSO4 被转化掉。
故转化掉的 BaSO4 的质量为 233 g·mol–1 ×1.2×10–2 mol =2.80 g 。



