氧化还原反应
上一节
下一节
化合价与氧化数
氧化-还原反应:有电子得失(或电子偏移)的反应。
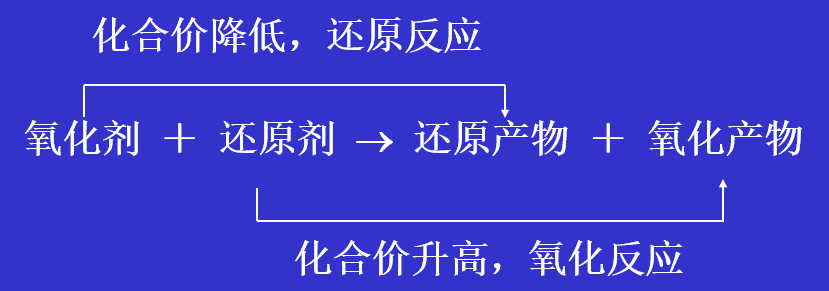
化合价:氧化还原反应中得失电子数,只能为整数。
氧化数:得失电子或平均化合价。可以为整数或分数。
氧化还原方程式的配平
原则:方程式两边的原子数和电荷相等。
配平电对 Cr2 O7 2 - /C r3 +的电极反应式。
1)将氧化数有变化的原子配平Cr2O7 2- ——2 Cr 3+
2)在缺少n 个氧原子的一侧加上n 个H2O,
Cr2 O7 2 - —— 2 C r 3+ + 7H2O
3)在缺少n 个氢原子的一侧加上n 个H +,平衡氢原子
Cr2 O7 2 - + 14H + —— 2 C r 3 + + 7H2O
4)加电子以平衡电荷,完成电极反应式的配平
Cr2 O7 2 - + 14H + + 6e - = 2 C r 3+ + 7H2O
例 10-2 配平氧化还原反应方程式
MnO4- + H2SO3 —— Mn 2+ + SO4 2 -
1)写出两个半反应并配平
MnO4 - + 8 H + + 5 e -= Mn2+ + 4H2O
SO4 2 - + 4H + + 2 e -= H2SO3 + H2O
2)调整化学计量数,使得失e数相等后,两式相减,得
2 MnO4-+5 H2SO3 =2 Mn2+ +5SO42-+4 H++3 H2O


