键的极性与分子的极性
化学键一般是指原子结合成分子和晶体的强作用力。离子键、共价键和金属键其键能约为100 ~ 800 kJ×mol-1。
分子之间弱的相互作用称为分子间作用力或范德华力(van der Waals force),其结合能比化学键能约小一、二个数量级,大约每摩尔为几到几十千焦。
电负性表示分子内原子对电子的吸引能力。在共价键中,若成键的两原子属于同种元素,电负性差值为零,这种共价键称为非极性共价键;若成键的两个原子所属的元素的电负性差值不等于零,这种共价键称为极性共价键。
由相同原子组成的双原子分子,如H2、Cl2等,两个原子的电负性相同,对共用电子对的吸引力相同,分子中电子云分布均匀,整个分子的正电荷重心与负电荷重心重合。这种分子叫非极性分子,分子中的键是非极性共价键
而由两个不同原子组成的双原子分子,如HCl,由于Cl 的电负性大于H,氯原子对共用电子对的吸引力大于氢原子,分子中电子云偏向氯原子,使氯原子一端显负电性,氢原子一端显正电性,分子的正电荷重心与负电荷重心不相重合,形成正负两极。这种分子叫极性分子,分子中的键是极性共价键。
键的极性与电负性差有关,两个原子的电负性差值越大,键的极性就越大。分子的极性不仅与键的极性有关,而且与分子的空间构型有关。如果组成分子的化学键是极性键,对于双原子分子则一定是极性分子,而对于多原子分子来说,就要考虑分子的空间构型。
例如,NH3和BF3两种分子,虽然 N-H 键和 B-F 键都是极性键,但是具有平面三角形构型的BF3分子,其正、负电荷重心相重合,是非极性分子;而具有三角锥形构型的NH3分子,其正、负电荷重心不重合,是极性分子。
在极性分子中,其极性的大小用偶极矩m来衡量。
显然,偶极矩的大小与正电荷重心与负电荷重心之间的距离—— 偶极长d,以及正负电荷重心的电荷量q有关。分子的偶极矩定义为分子的偶极长与偶极一端的电荷量的乘积,即 m=q×d
偶极矩m的单位称为“德拜”,用 D 表示。当偶极的电荷量q为1.602´10-19C,偶极长d为1´10-10m时,m=4.8 D。所以 1D = 3.33´10-30C×m。
极性分子 | H2O | HCl | HBr | HI | H2S | SO2 | NH3 |
m∕D | 1.85 | 1.03 | 0.70 | 0.38 | 1.1 | 1.6 | 1.66 |
偶极矩是矢量,其方向是从正电重心指向负电重心。
化学键的极性也可以用键的偶极矩衡量,分子中各个化学键的偶极矩的矢量和,等于分子的偶极矩。偶极矩m为 0 的分子当然是非极性分子。偶极矩m是否为 0,有助于判断分子的空间结构。
如CO2和SO2分子均属于AB2型分子,测得前者的偶极矩为0,说明分子是非极性的,当然属于直线形;而测得后者的偶极矩m=1.6 D,说明分子是极性的,当然属于“V” 字形。
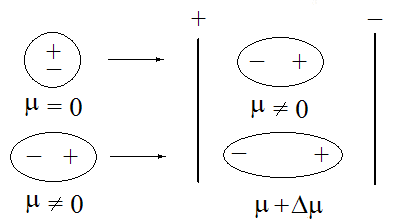
图(1)外电场对分子极性的影响
由于极性分子的正、负电荷重心不重合,因此分子中始终存在一个正极和一个负极,这种极性分子本身固有的偶极矩称为固有偶极或永久偶极。但是分子的极性并不是固定不变的,在外界电场作用下非极性分子和极性分子中的正、负电荷重心会发生变化,如图(1)所示。


