溶度积常数
上一节
下一节
溶度积原理
溶度积常数
当溶解过程产生的 Ag+ 和 Cl- 的数目和沉淀过程消耗的 Ag+ 和 Cl- 的数目相同,即两个过程进行的速率相等时,便达到沉淀溶解平衡。可以表示成:

该平衡常数又可称为溶度积常数,用 Ksp 表示。由于难溶性强电解质的溶液都是极稀的溶液,可用浓度代替活度。故上述沉淀溶解平衡的Ksp 可以表示为:

溶度积原理
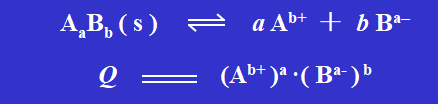
溶度积原理:
当 Q> Ksp 时,沉淀从溶液中析出;
当 Q= Ksp 时,饱和溶液与沉淀物平衡;
当 Q< Ksp 时,溶液不饱和,若体系中有沉淀物,则沉淀物将发生溶解。
同离子效应对溶解度的影响
例: 求在 1.0 mol·dm–3 的盐酸中,AgCl 固体的溶解度。
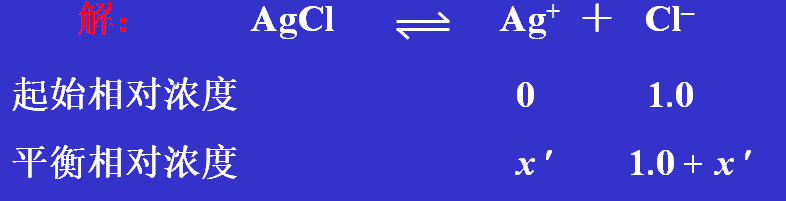 达到饱和时 [Ag+ ] 可以代表 AgCl 的溶解度
达到饱和时 [Ag+ ] 可以代表 AgCl 的溶解度

纯水中 AgCl 的溶解度为1.3×10–5 mol·dm–3,故:
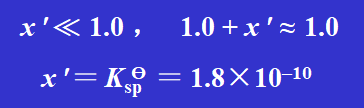
在 1 mol·dm–3 的盐酸中,AgCl 的溶解度为1.8×10–10 mol·dm–3 。它仅是 AgCl 在纯水中溶解度1.3×10–5 mol·dm–3 的 7.2 万分之一。
溶度积与溶解度的关系
例:已知 AgCl 的 Ksp θ = 1.8×10–10,求 AgCl 的溶解度

例: 已知某温度下 Ag2CrO4 的溶解度为 6.50×10–5 mol·dm–3,求 Ag2CrO4 的 KspӨ。

饱和溶液中 [CrO42–] 可以代表 Ag2CrO4 的溶解度,而 [Ag+] 则是 Ag2CrO4 溶解度的 2 倍。

结论: Kspθ和溶解度之间具有明确的换算关系。但尽管两者均表示难溶物的溶解性质,但 Kspθ大的其溶解度不一定就大。
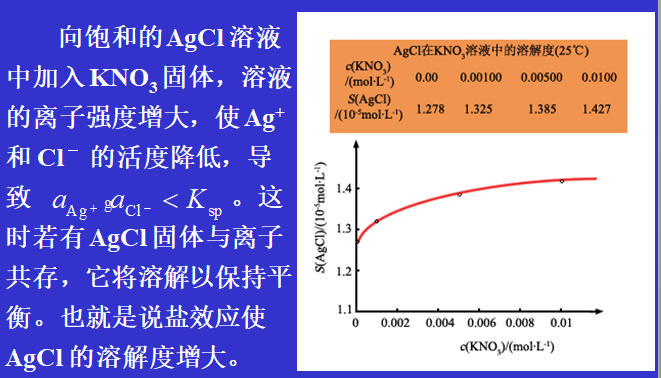
在难溶性强电解质的溶液中,加入与其具有相同离子的强电解质,将使难溶性强电解质的溶解度减小,这一作用称为同离子效应。
盐效应对溶解度的影响