理论 ( Lewis theory )
离子键理论能够很好地解释许多离子化合物的形成和性质,但它不能说明由同种元素的原子组成的单质分子的形成,也不能说明由电负性相近元素的原子也能形成稳定的分子。1916 年美国化学家 G. N. Lewis 为了说明上述分子的形成,提出了共价键理论。Lewis 认为,同种原子之间以及电负性相近的原子之间可以通过共用电子对形成分子,通过共用电子对形成的 化学键称为共价键 (covalent bond),形成的分子称为共价分子。
在分子中,每个原子均应具有稳定的稀有气体原子的 8 电子外层电子构型 (He 为 2 电子),习惯上称为“八隅 体规则”。分子中原子间不是通过电子的转移,而是通过 共用一对或几对电子来实现 8 电子稳定构型的。每一个共 价分子都有一种稳定的结构形式,称为Lewis 结构式。
在Lewis结构式中,用小黑点表示电子,如:
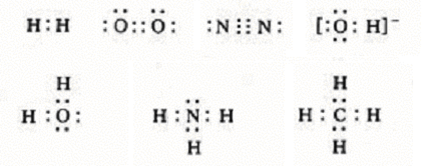
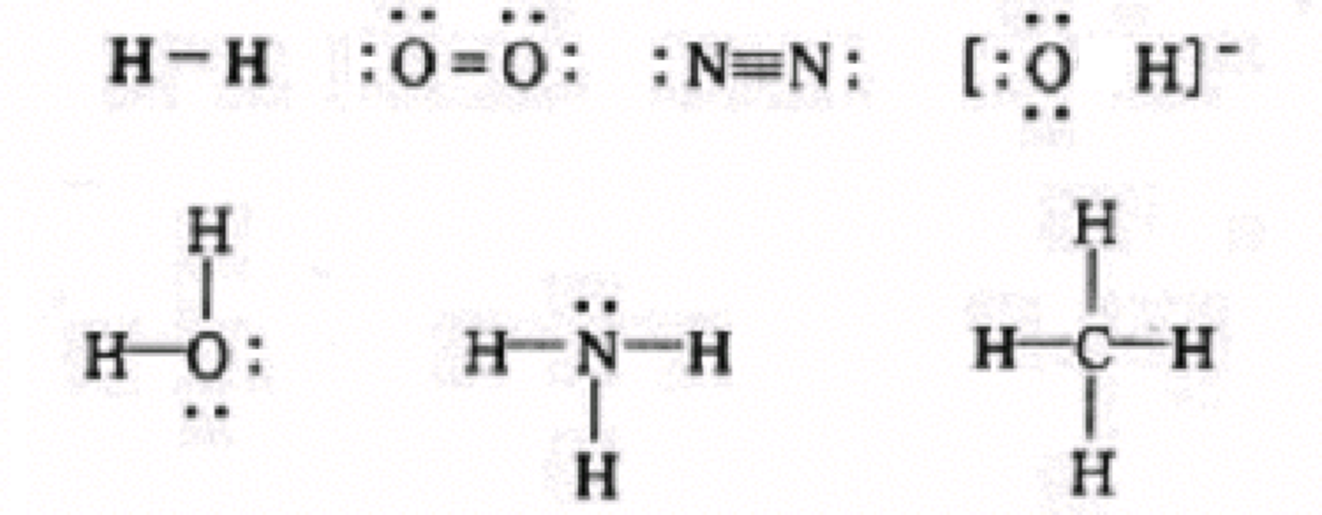
为了表示方便,共用一对电子通常用一短线代表,即表示形成一个单键,共用两对电子,则用两道短线表示,形成一个双键,共用三对电子,则用三道短线表示,形成一个叁键,如
对于复杂分子,先根据分子中各原子的价电子数计算出分子的总价电子数,写出骨架结构式,根据“八隅体规则” 判断该分子的 Lewis 结构式。
甲醛 (CH2O),总的电子数为4 + ( 1 ´ 2 ) + 6 = 12,其骨架结构式为 HHCO,用去了三对电子,即6 个电子,还剩下的6 个电子有如下三种排布方式
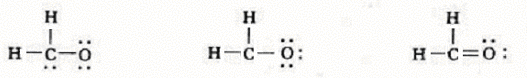
根据“八隅体规则” 很容易判断出 (c) 为甲醛的 Lewis 结构式。
又如NO +离子,其价电子总数等于10,即氮原子和氧原子的价电子数相加再减去一个电子。
![]()
它的骨架结构只能是 N-O,用去 2 个电子,剩下 8 个电子无论是按图(a)中以孤对方式分配给两个原子, 还是按(b)和(c)那样将 N-O 单键改成双键,都不能满足“八隅体规则”,只有将单键改成叁键,才能满足要 求。
因此,(d)才是 NO + 离子的 Lewis 结构式。应该注意的是,电荷标在了物种的右上角,表示该电荷为整个物种所有而不属于该物种的某个原子。
Lewis 的共价键概念初步解释了一些简单非金属原子间形成共价分子(或离子)的过程以及与离子键的区别,但没有揭示共价键的本质和特征。另外,“八隅体规则”例外的情况很多,如在 BeF 2 ,BF 3 , PCl 5 和 SF 6 分子中。某些分子即使可以表示出 8 电子结构,但分子表现出来的性质也与该种路易斯电子结构式不符,如 O 2 分子的磁性等。
Lewis 的电子对成键概念为现代共价键理论奠定了基础。


