20 世纪 20 年代 Brfnsted和 Lowrey提出了质子酸碱理论,大大地扩大了酸碱的物种范围,使酸碱理论的适用范围扩展到非水体系乃至无溶剂体系。
1 酸碱定义
酸碱质子理论将能给出质子 (H+) 的分子或离子定义为酸;能接受质子的分子或离子定义为碱。
HCl,NH4+,H2PO4-等都是质子酸 。
NH3,HPO42-,CO32-,[Al(H2O)5OH]2+ 等都是碱。
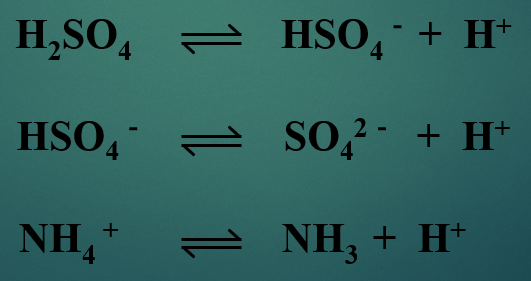
反应式中,左边的物质都是质子酸;这些质子酸在反应中给出质子后,形成的物质都是质子碱。
通过上面的酸碱定义及举例,我们应意识到如下几点:
1) 酸和碱均可以是分子、正离子和负离子;
2) 有的物质在不同的反应中可以是酸,也可以是碱,如HSO4-;
3) 酸和碱之间的关系是:

在质子酸碱理论中仍可用解离平衡常数来表示酸和碱的强度,例如:
HCl > H3O+ >HF >HAc> NH4+> H2O
HAc 在 H2O 中解离:
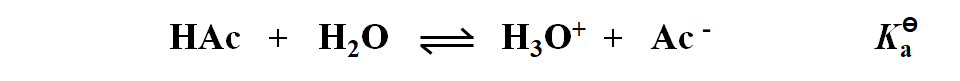
HAc的共轭碱 Ac- 在水中水解:
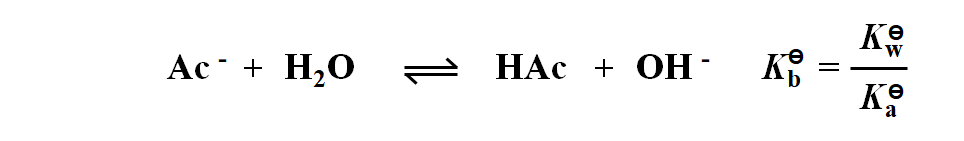
从二者的关系可以看出,一对共轭酸碱,其电离平衡常数之积等于定值。故酸越强越大,其共轭碱越弱越小。因此将上述这些酸的共轭碱按着碱性从弱到强排列起来,则有:
Cl- < H2O <F- <Ac- <NH3 <OH-
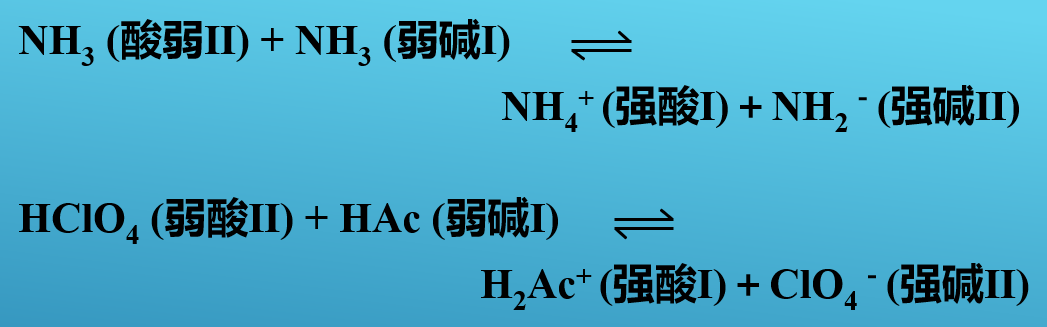
阿仑尼乌斯酸碱体系中的一些反应,可以归结为质子酸碱理论中的酸与碱的反应。其实质是强酸I 将质子转移给强碱 II,生成弱酸 Ⅱ 和弱碱 Ⅰ。
酸碱反应中标志相同的一对酸和碱,如强酸Ⅰ和弱碱Ⅰ,弱酸Ⅱ和强碱Ⅱ分别具有共轭关系。
例如:

 强酸 HClO4,H2SO4,HCl,HNO3在 H2O 中完全解离,水拉平了这些强酸给出质子的能力,因此在水中不能分辨出这些酸的强弱。
强酸 HClO4,H2SO4,HCl,HNO3在 H2O 中完全解离,水拉平了这些强酸给出质子的能力,因此在水中不能分辨出这些酸的强弱。
若将这些强酸放在比 H2O 难于接受质子的溶剂中,如放在 HAc中,就可以分辨出它们给出质子的能力强弱 :


