催化剂对反应速率的影响
上一节
下一节
催化剂与催化反应简介
① H2 (g) + 1/2 O2 (g) = H2O(l)
ΔrGmӨ=-237.1 kJ·mol-1
② H2 (g) + O2 (g) = H2O2 (l)
ΔrGmӨ=-120.4 kJ·mol-1
③3/2H2 (g) + 1/2 N2 (g) = NH3 (g)
ΔrGmӨ=-16.4 kJ·mol-1
在热力学上看,均为常温常压下可以自发进行的反应。但是由于反应速率过慢,在通常的条件下不能得到人们所希望的反应 ① 释放的能量和反应 ②、③ 的产物。
催化剂和催化作用的基本特征
催化剂:存在少量就能加快反应而本身最后并无损耗的物质。
催化作用的特点 :
①只能对热力学上可能发生的反应起作用。
②通过改变反应途径以缩短达到平衡的时间。
③催化剂有选择性,选择不同的催化剂会有 利于不同种产物的生成。
④只有在特定的条件下催化剂才能表现活性。
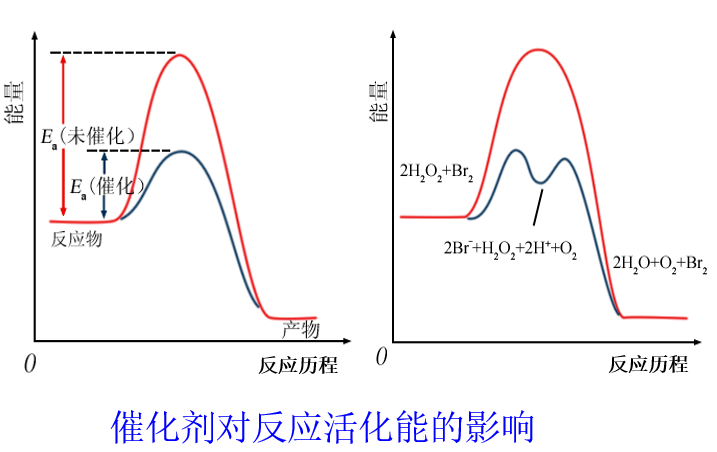
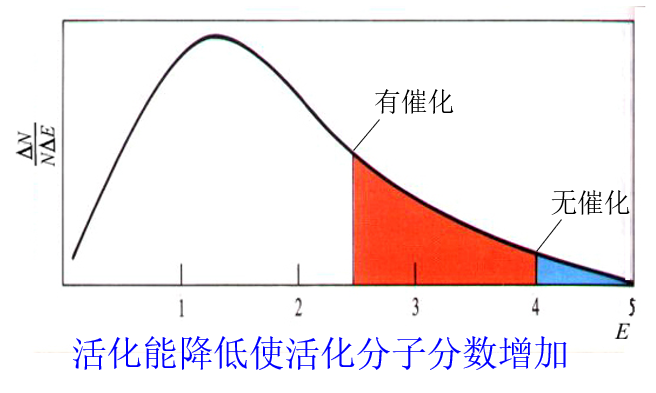
实验结果表明,催化剂参与的分解反应,改变了反应机理,降低了反应活化能,增大了活化分子分数,反应速率显著增大。
多相催化:
催化剂与反应物种不属于同一物相的催化反应。
酶催化
酶催化:以酶为催化剂的反应。
特点:①高效
②高选择性
③条件温和


