速率方程
基元反应:指反应物分子一步直接生成产物的反应。
质量作用定律:基元反应的速率与反应物浓度以其 化学计量数为幂指数的连乘积成正比。基元反应
对于基元反应 aA+bB= gG+ hH
质量作用定律的数学表达式:
k称为速率常数
m,n 称反应物A,B的反应级数
k,m和n均可由实验测得
反应级数
若某化学反应 aA+ bB= gG+ hH
其速率方程为 r = kc(A ) m c(B) n
则反应级数为 m+ n
对于化学反应 2 H2 + 2 NO = 2 H2O + N2
其速率方程为 r = k c(H2) c(NO)2
该反应是三级反应,或者说反应对H2是1级,对NO是2级。
反应级数可以为零,也可以为分数。例如反应
2 Na (s) + 2 H2O = 2 NaOH (aq) + H2 (g)
其速率方程为 r = k
零级反应的反应速率与反应物浓度无关。
有的反应速率方程较复杂,不属于 r = k c(A) m c(B) n 形式,对于这样的反应则不好谈反应级数。
如 H2 (g) + Br2 (g) = 2 HBr (g)的速率方程为:
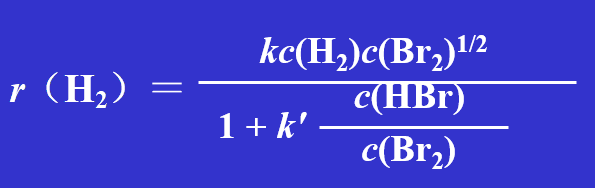
速率常数k
化学反应速率常数k是在给定温度下,各反应物浓度皆为 1 mol·dm-3时的反应速率,因此也称比速率常数。速率常数是温度的函数。
速率常数的单位与反应级数有关:
一级反应 s-1
二级反应 dm3·mol-1·s-1
n级反应 dm3(n-1)·mol-1(n-1)·s-1
反应物浓度与时间的关系
零级反应
若零级反应 A → H
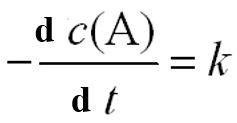
c(A) = c(A) 0- k t
反应物消耗一半所需的时间称为半衰期,用t1/2表示。即零级反应的半衰期公式,

零级反应半衰期与速率常数k和初始浓度c0 有关。
一级反应 SO2Cl2 = SO2 + Cl2
速率方程为 - dc/dt = k c
即:lnc- lnc0= - k t


