-
1 讲义
-
2 课件
实验七 目的基因的PCR扩增
(Gene Amplification by PCR)
PCR目的
•进行体外(试管内)DNA片段扩增
•能够扩增特异的基因
•能够扩增至百万倍
•优点:敏感度高、特异性强、产率高、重复性好以及快速简便等
一、PCR基本原理
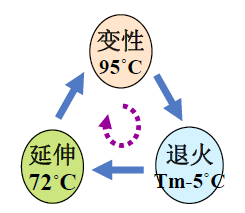
•三步曲: 变性、退火、延伸
•类似于DNA的体内复制。
–变性:待扩增DNA模板加热变性解链
–退火:将反应混合物冷却至某一温度,使引物与靶序列退火
–延伸:将温度升高使退火引物在DNA聚合酶作用下延伸。
•这种热变性-复性-延伸的过程就是一个PCR循环。PCR就是在合适条件下的这种循环的不断重复。
PCR:体外由引物介导的DNA酶促合成,也叫基因扩增。
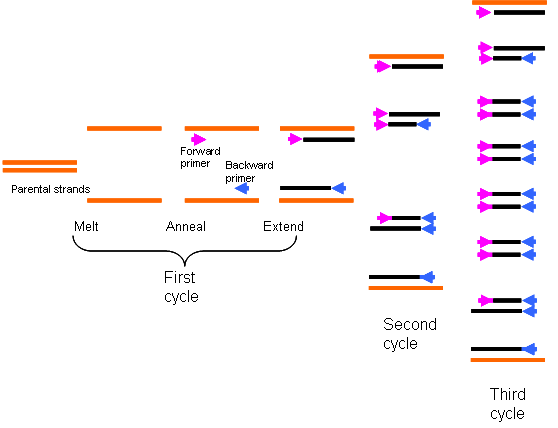
25~30 次循环后,模板DNA的含量可以扩大100万倍以上。
•PCR的主要用途
目的基因的克隆
基因的体外突变
DNA和RNA的微量分析
DNA序列测定
二、PCR体系基本组成成分(五要素)
模板DNA Template特异性引物Primer耐热TaqDNA聚合酶4种dNTPs含Mg2+的缓冲液
1、模板
•包括基因组DNA、RNA、质粒DNA、线粒体DNA等
•RNA作为模板时,须先将RNA逆转录为cDNA,再以cDNA作为扩增的模板
•模板量:1000ng、500ng、100ng、50ng…
过高:非特异产物增加
过低:产量降低
•对标本的纯度要求低,DNA 粗制品及RNA均可作为扩增模板。可直接用临床标本如血液、体腔液、洗嗽液、毛发、细胞、活组织等DNA扩增检测。
2、引物(Primers)
•是化学合成的寡核苷酸片段,能与模板特异结合
•引物决定PCR扩增产物的特异性和长度
•引物浓度:0.1 ~ 0.5 μmol/L
–偏高:非特异产物扩增及错配,增加引物之间形成引物二聚体,产量降低。
–偏低:产量降低。
设计引物应遵循以下原则:
①引物长度:15-30bp,常用为20 bp左右。
②引物扩增跨度:以200-500 bp为宜,特定条件下可扩增长至10kb的片段。
③避免引物内部出现二级结构,避免两条引物间互补,特别是3'端的互补,否则会形成引物二聚体,产生非特异的扩增条带。
④引物3'端的碱基,特别是最末及倒数第二个碱基,应严格配对,以避免因末端碱基不配对而导致PCR失败。
⑤引物中有或能加上合适的酶切位点。被扩增的靶序列最好有适宜的酶切位点,这对酶切分析或分子克隆很有好处。
⑥引物的碱基顺序不应与非扩增区域有同源性(<70%)。
⑦引物退火温度计算:Tm=2(A+T)+4(C+G)。
3、脱氧核苷三磷酸(dNTP)
•是dATP、dCTP、dGTP和dTTP4种脱氧核苷三磷酸的混合物
•反应体系中各种核苷酸的浓度必须一致
•浓度过高虽能加快反应速度,但非特异
性扩增也随之增加
•dNTP浓度:50 ~400 μmol/L
4、耐热DNA聚合酶
•从一种生活在热泉(80℃~90℃)中的嗜热水生菌(Thermusaquaticus, Taq)中提取出来,有很高的热稳定性。
•Taq酶的作用:模板指导下,以dNTP为原料,在引物3’-OH末端加上脱氧单核苷酸,形成3’, 5’-磷酸二酯键,使DNA链沿5’→3’方向延伸,催化DNA合成。
•最适酶量:2-4U(酶量过多,导致非特异性扩增)。
•TaqDNA聚合酶复制的保真性:
–TaqDNA聚合酶无3’→5’外切酶活性,因而无校正功能,在复制新链的过程中会发生碱基错配。
–TaqDNA聚合酶在每次循环中产生的移码突变率为1/30000,碱基替换率为1/8000,故扩增的片段越长,错配的机率越高。
•PyrobestTMpolymerase 、PfuDNA polymerase:有较高的保真性,碱基错配率下降2 ~10倍。
5、镁离子浓度
•镁离子浓度是一个至为关键的因素,对于反应系统本身、稳定核苷酸和提高Taq酶的活性有直接影响。
•虽然Taq酶的活性只与游离的Mg2+浓度有关,但PCR反应体系中dNTP、引物、模板DNA及鳌合剂的存在均可与Mg2+结合而降低游离Mg2+的浓度从而影响酶的活性。
•当dNTP浓度为200 μmol/L时,MgCl2的浓度为1.5~2.0 mmol/L较宜。
6、反应缓冲液
•一般随TaqDNA聚合酶供应。
•标准缓冲液含:10mM Tris-HCl(pH8.3),50mM KCl,1.5mM MgCl2。
–10mMTris-Cl(pH8.3):维持Taq酶作用环境的偏碱性
–50 mMKCl:促进引物退火,>50 mM会抑制Taq酶的活性。
•100 μg/ ml 牛血清白蛋白(BSA):对酶有一定的保护性,如质量不好将起相反的作用,建议使用乙酰化的BSA。明胶、Tween-20、二硫苏糖醇(DTT) 也有类似作用。
7、标准的PCR反应体系
10×PCR Buffer 10 μl
4种dNTP混合物各200 μmol/L
引物10.2~1.0 μmol/L
引物20.2~1.0 μmol/L
模板DNA 0.1~2 μg
TaqDNA聚合酶2.5 U
Mg2+1.5 mmol/L
加双或三蒸水至100 μl
三、PCR反应条件
预变性94~95℃,5 min
•循环(25~35)
–变性94℃,30s
–退火52~60 ℃,30s
–延伸70~75℃,30~60s
•延伸72℃,10 min
1、变性温度和时间
•保证模板DNA解链完全是保证整个PCR扩增成功的关键。
•一般情况下选择94℃,30s,可使各种复杂的DNA分子完全变性。
•温度过高或高温持续时间过长,可对Taq酶活性和dNTP分子造成损害。
2、复性温度和时间
•复性温度的选择,可根据引物的长度和G+C含量确定。引物长度在15~25bp 之间时,Tm=4(G+C)+2(A+T)。复性温度低于引物Tm值5 ℃左右。
•退火时间设置为30s,足以使引物与模板之间完全结合。
•复性温度越高,产物特异性越高。复性温度越低,产物特异性越低。
3、延伸温度和时间
•一般位于Taq酶最适作用温度70~75℃之间。
•延伸反应时间,可根据待扩增片段的长度而定:
–< 1Kb,1min足够;
–> 1Kb需加长延伸时间,10Kb片段延伸时间可达15分钟。
•延伸时间过长可出现非特异扩增,常用72 ℃,1min。
4、循环次数
•其他参数选定后,PCR循环次数主要取决于模板DNA的浓度。
•理论上说20~25次循环后,PCR产物的积累即可达到最大值,实际操作中由于每步反应的产率不可能达到100%,因此不管模板浓度是多少,20~30次是比较合理的循环次数。
•循环次数越多,非特异扩增增加。
四、实验操作
1.在冰浴中将以下各成分加入一无菌0.2 ml离心管中。

•将上述混合液用手指轻弹管壁后再稍加离心(5秒),使溶液集中在管底,然后立即置于PCR仪上进行扩增。
2.PCR反应程序
①94℃,预变性5min;
②94℃,30s;
③53℃,30s;
④72℃,1m10s;
⑤go to ②, 循环30次;
⑥72℃,最后延伸5min;
⑦End
•预变性(Initial denaturation):模板DNA完全变性对PCR能否成功至关重要,一般95℃加热3-5min。
•最后延伸:在最后一个循环后,反应在72℃维持5-15min.使引物延伸完全,并使单链产物退火成双链。
3.结束反应,PCR产物置于4℃待电泳检测或-20℃长期保存。
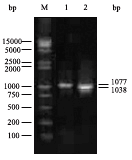
4.PCR的电泳检测:取5 μl 进行琼脂糖凝胶电泳检测。
五、PTC-150 PCR仪使用方法
1.开机:打开电源开关,视窗上显示“SELF TEST”,10秒后,显示RUN-ENTER菜单“RUN PROGRAM, ENTER PROGRAM”准备执行程序。
2.放入样本管,盖好热盖。
3. 按下表所示各键的功能进行程序的编辑、列表和修改等。
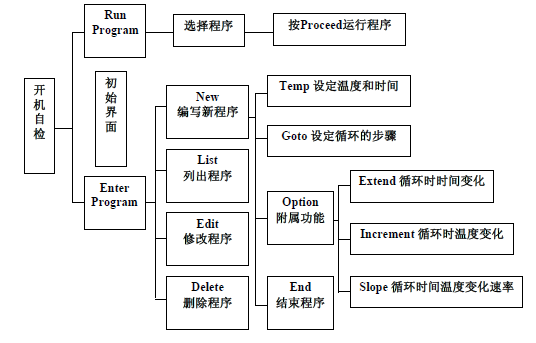
•输入完成后,到RUN-ENTER菜单,选择程序,按“Proceed”,视窗上显示“Use heated lid”,选择“Yes”,开始运行程序。
六、思考题
1. 通过本实验,谈谈PCR反应体系中各成分在PCR反应中的作用。
2. 污染是PCR反应中最常见的问题,可采用哪些措施防止污染?
3. PCR引物设计的原则有哪些?如何进行PCR反应条件的选择?


