-
1 讲义
-
2 课件
实验三 DNA的琼脂糖凝胶电泳
(DNA AgaroseGel Electrophoresis)
实验目的
掌握琼脂糖凝胶电泳检测DNA的原理和方法
简介
一、琼脂糖凝胶电泳
•琼脂糖凝胶电泳是分离鉴定和纯化DNA片段的标准方法。
•该技术操作简便快速,可以分辨用其它方法(如密度梯度离心法)所无法分离的DNA片段。
•当用低浓度的荧光嵌入染料溴化乙啶(Ethidiumbromide, EB)染色,在紫外光下至少可以检出1-10ng的DNA条带,从而可以确定DNA片段在凝胶中的位置。
•此外,还可以从电泳后的凝胶中回收特定的DNA条带,用于以后的克隆操作。
二、琼脂糖凝胶
•天然琼脂(agar):又名琼胶、菜燕、冻粉从石花菜及其它红藻类植物提取出来的一种线状高聚物。琼脂糖(agarose)琼脂胶(agaropectin):含硫酸根和羧基的强酸性多糖,在电场作用下能产生较强的电渗现象。
•琼脂糖
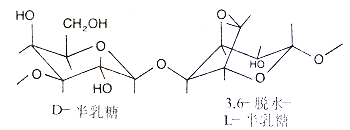
–琼脂糖是由琼脂中提取出来的,D-半乳糖和3、6-脱水-L-半乳糖结合的链状多糖。
–中性物质,不带电荷
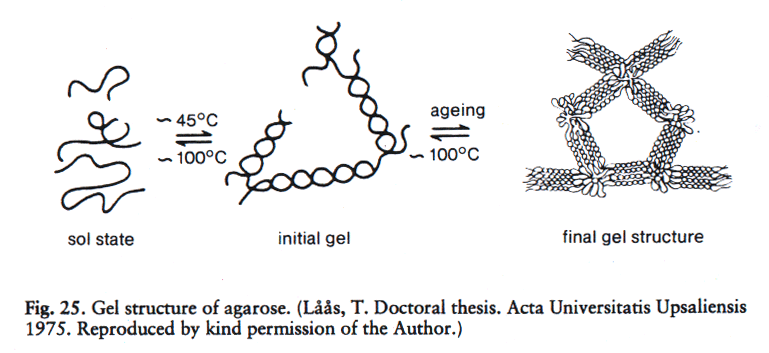
琼脂糖链依分子内和分子间氢键及其它力的作用使其互相盘绕形成绳状琼脂糖束,构成大网孔型凝胶。
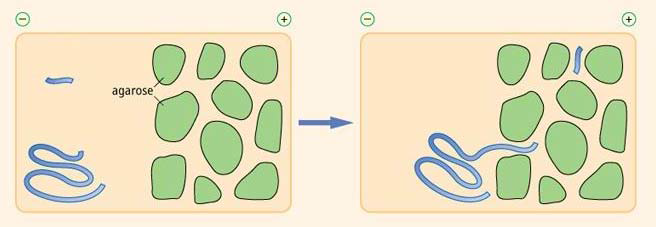
三、琼脂糖凝胶的优点
(1)操作简单,电泳速度快,样品不需事先处理就进行电泳。
(2)琼脂糖凝胶结构均匀,对样品吸附极微,因此电泳图谱清晰,分辨率高,重复性好。
(3)琼脂糖透明无紫外吸收,电泳过程和结果可直接用紫外监测及定量分析。
(4)电泳后区带易染色,样品易洗脱,便于定量测定。制成干膜可长期保存。
四、缺点:
1. 机械强度差, 易破碎,浓度不能太低。
2. 易被细菌污染 ,不易保存,临用前配制。
3. 琼脂糖支持层上的 区带易于扩散 ,电泳后
必须立即固定染色。
4. 与PAGE 相比, 分子筛作用小 ,区带少。
五、影响琼脂糖凝胶电泳的因素
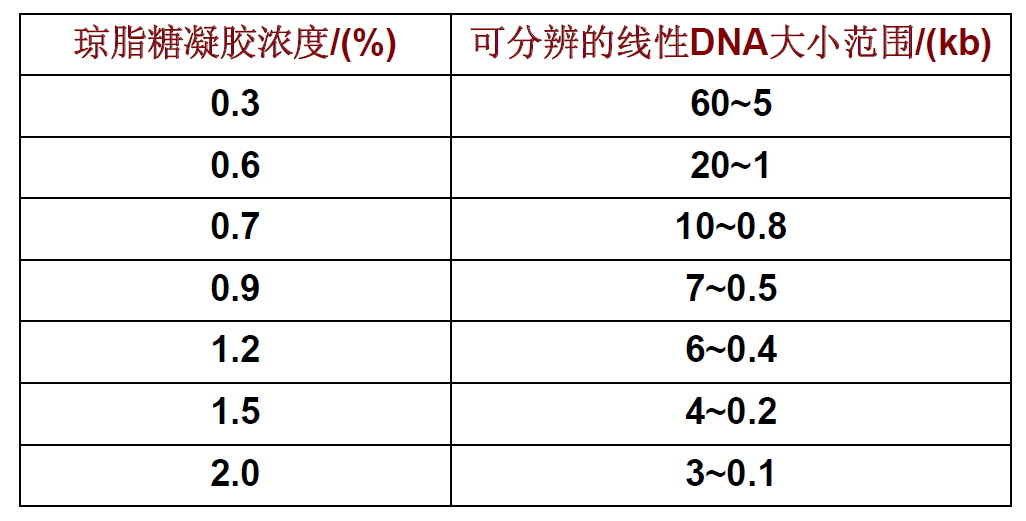
•DNA分子的大小:实验证明,DNA片段迁移距离与其分子量的对数成反比;
•琼脂糖的浓度:一定大小的DNA片段在不同浓度的琼脂凝胶中,电泳迁移率不相同;
•DNA分子的构型:不同构型的DNA在琼脂糖凝胶中的电泳速度差别较大。
六、琼脂糖凝胶浓度与可分辨的DNA大小范围的关系(下图)
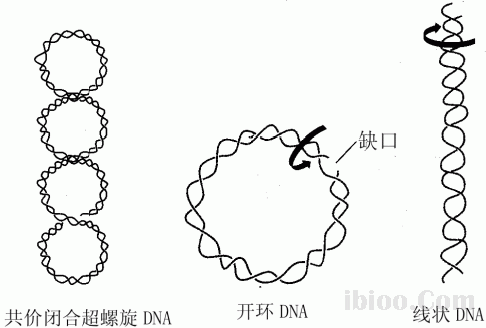
七、核酸构型与琼脂糖凝胶电泳分离的关系
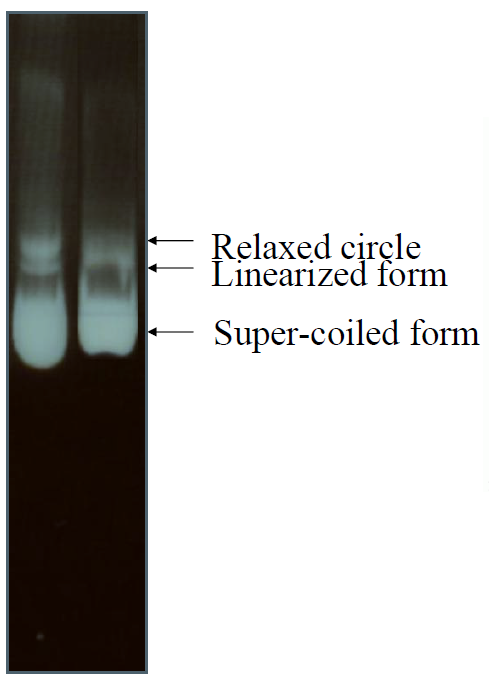
•在分子量相当的情况下,不同构型的DNA的移动速度次序如下:
–共价闭环DNA(covalently closed circular,简称cccDNA)>直线DNA>开环的双链环状DNA
试剂
•琼脂糖 •电泳缓冲液 •上样缓冲液 •染色剂
1.电泳缓冲液
•常用三种缓冲液
–Tris-硼酸(TBE)
–Tris-乙酸(TAE)
–Tris-磷酸(TPE)
•Tris(三羟甲基氨基甲烷):是一种生物碱,常用于生物实验中配制各种pH值的缓冲液。1M的Tris溶液的pH值大约是10~11。
•EDTA(乙二胺四乙酸,ethylenediaminetetraaceticacid),可螯合二价阳离子,抑制DNA酶的活性,防止DNA降解。
•TBE与TPE:缓冲容量高,DNA分离效果好,但TPE在DNA片段回收时含磷酸盐浓度高,容易使DNA沉淀,
•TAE:缓冲容量低,但价格较便宜。
(1)5×TBE缓冲液的配制
•配方
–Tris108克
–EDTA 9.3克
–硼酸55克
–H2O至1000ml
•pH应为8.0~8.2
•临用时用水稀至0.5×TBE(10倍稀释)
2.上样缓冲液
•0.25%溴酚兰;0.25%二甲苯青;30%甘油水溶液
•作用:
–①增加样品密度,使其比重增加,以确保DNA均匀沉入加样孔内
–②在电泳中形成肉眼可见的指
示带,可预测核酸电泳的速度和位置
–③使样品呈色,使加样操作更方便
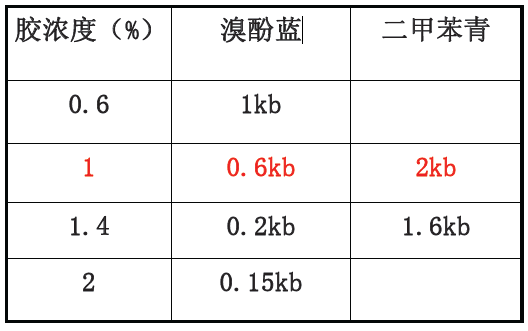
(1)电泳指示剂:
核酸电泳常用的指示剂有两种
•溴酚蓝(bromophenolblue, Bb )呈蓝紫色;
•二甲苯青(xylenecyanol, Xc)呈蓝色,它携带的电荷量比溴酚蓝少,在凝胶中的迁移率比溴酚蓝慢
3. 核酸电泳的染色剂
•最常用的染色剂
–溴化乙锭
–银染色
(1)溴化乙锭(ethidiumbromide,EB)
–EB能插入核酸分子中的碱基对之间,在紫外线(254nm,300nm或360nm)激发下,发出红色荧光。
–EB-DNA复合物中的EB发出的荧光,比游离的凝胶中的EB本身发射的荧光强度大10倍,因此不需要洗净背景就能较清楚地观察到核酸的电泳带型。

溴化乙锭染料的化学结构及其对DNA分子的插入作用(上图)
由于插入了溴化乙锭分子,在紫外光照射下,琼脂糖凝胶电泳中DNA的条带便呈现出橘黄色荧光,易于鉴定。
(2)溴化乙锭(ethidiumbromide,EB)
–EB染料有许多优点,如染色操作简便、快速,灵敏度高,10ng或更少的DNA即可检出。
–可在凝胶电泳液中加入终浓度为0.5ug/ml的EB,有时亦可在电泳后,将凝胶浸入该浓度的溶液中染色10~15min。
注意:溴化乙锭可以嵌入碱基分子中,导致错配。溴化乙锭是强诱变剂,具有高致癌性!操作时应尽量小心,配置和使用EB时都应带上手套,且注意不要把EB洒到桌面或地板上。
(3)SYBR
•SYBR染料为一种非对称菁化物,它作为DNA和RNA染料,与菲啶类染料如溴化乙锭相比具有一定优越性。
•三种常用的SYBR染料:SYBR GreenⅠ、SYBR GreenⅡ和SYBR Glod。SYBR Glod是最好的SYBR染料,灵敏度很高。
•三种染料在溶液状态基本不产生荧光,当其结合到核酸上,将产生很强的荧光。由于SYBR染料能产生很强的信号和极低的背景以及对核酸的高度亲和力,它们能在低浓度条件下使用,可检出20pg DNA,高于EB染色法25-100倍。
•SYBR类染料主要结合在DNA主链的带电磷酸残基上,毒性低,操作更安全。
实验原理
•DNA分子在琼脂糖中泳动时有电荷效应和分子筛应,但主要为分子筛效应。
•在pH 值为8.0~8.3 时,核酸分子碱基几乎不解离,磷酸全部解离,核酸分子带负电,在电泳时向正极移动。
•采用适当浓度的凝胶介质作为电泳支持物,在分子筛的作用下,使分子大小和构象不同的核酸分子泳动率出现较大的差异,从而达到分离核酸片段检测其大小的目的。
•核酸分子中嵌入荧光染料(如EB )后,在紫外灯下可观察到核酸片段所在的位置。
实验器材和试剂
•实验器材:
–制胶模具,水平式电泳槽,电泳仪,微量移液器, 微波炉, 紫外透射仪或凝胶成像系统。
•样品:DNA分子量标准品,质粒
•试剂
–琼脂糖
–0.5×电泳缓冲液(TBE)
–6×上样缓冲液
–溴化乙锭(EB) :10mg/ml

实验操作

1、用蒸馏水将电泳槽和梳子冲洗干净,放在水平桌面上,并架好梳子。

2. 配制1%琼脂糖凝胶及倒胶。
具体步骤:
•三角瓶内:1g琼脂糖+ 0.5×TBE 100ml
•煮胶溶解
•冷却至60℃(不烫手)
•加EB
•倒板•
室温下充分凝固
•垂直向上拔出梳子
•将胶板放入电泳槽
•向电泳槽中加入0.5×TBE缓冲液至刚没过凝胶表面。
3.加样
•将DNA样品(5ul)与6 ×上样缓冲液(1ul)混匀后,用微量加样枪小心加入样品孔内。
–注意加样枪的枪头不可插入过深,以免刺穿凝胶,导致样品外溢。
•每加完一个样品要更换枪头,以防止EB污染。

4、通电
•接通电源,一般红色为正极,黑色为负极,切记DNA样品由负极往正极泳动(靠近加样孔的一端为负),电压为5V/cm(长度以两个电极之间的距离计算)
•根据指示剂泳动的位置,判断是否终止电泳。

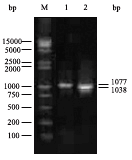
5、结果观察
•电泳结束后,将凝胶板取出。在紫外仪上观察电泳带及其位置,记录实验结果。

注意事项
1、倒胶时把握好胶的温度,不要高于60℃,否则温度太高会使制板变形;
2、胶一定要凝固好才能拔梳子,方向一定要竖直向上,不要弄坏点样孔;
3 、点样时枪头下伸,点样孔内不能有气泡,不要刺穿凝胶;
4、EB有毒,切勿用手接触,更不要污染环境,胶勿乱扔;
5 、紫外线照射不要太久。
结果与讨论
•绘制实验装置图及实验结果示意图。
思考题
–琼脂糖与琼脂有什么不同?相对琼脂而言,琼脂糖凝胶有何优点?
–上样缓冲液由哪些成分组成?各有何作用?
–为何要在DNA电泳缓冲液中加入EDTA?