第二节 微 丝
学习要求
知识内容
一、 微丝的结构、 化学组成与装配 (一) 微丝的结构、 化学组成 微丝 (microfilament,MF)又 名 肌 动 蛋 白 丝 (actinfilament),直 径 仅 约 6nm, 是细胞骨架中最细的一种。它是由许多的球形、名为 “肌动蛋白”的蛋白单体合聚合 而成。根据形状的差别,球形肌动蛋白单体又称为 Globularactin(GGactin);而由其聚 合而成的、纤维状的肌动蛋白丝或微丝称为 Filamentousactin (FGactin)。在人体细胞 中,G-actin主要有三种亚型:α-actin与 γ-actin存在于骨骼肌、心肌、平滑肌细 胞,而β-actin存在于非肌肉细胞中。 所有肌动蛋白亚型均是由375个氨基酸组装而成的一条多肽链,有序折叠后形成 电子显微镜下可见的大、小两个结构域。当肌动蛋白聚合成微丝后,小结构域位于聚 合体的外侧,所以又得名 “外结构域”,大结构域位于内侧,也称 “内结构域”。小结 构域内,又可根据肽链的折叠情况,分为亚结构域 1 (Subdomain1)和亚结构域 2 (Subdomain2),大结构域内则包含亚结构域3 (Subdomain3)和亚结构域4 (SubdoG main4)。其中,亚结构域2和亚结构域4之间形成的裂隙含有 ATP和二价阳离子 (如 Mg2+ 、Ca2+ )的结合位点;而亚结构域1和亚结构域3之间形成的裂隙则因分布有一 系列的疏水氨基酸,所以成为肌动蛋白结合蛋白 (Actin-bindingproteins,ABPs)的 结合位点,并且也成为介导微丝纵向结构单体之间结合的一个重要位点 (图6G2G1)
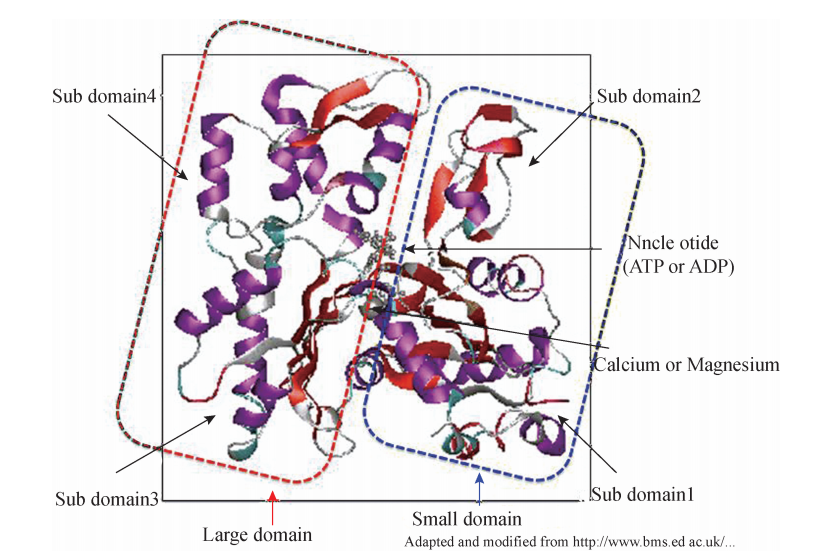
肌动蛋白的空间结构
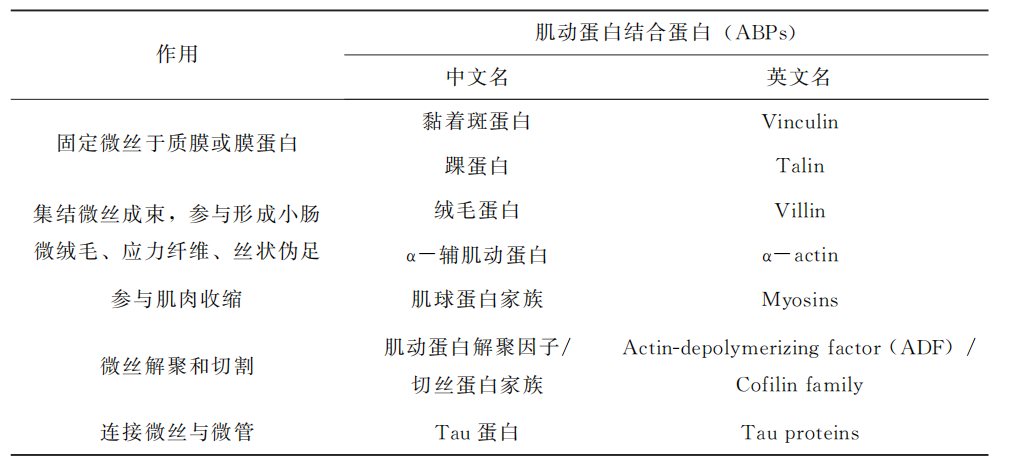
除了肌动蛋白外,还有些蛋白参与微丝的形成,这些蛋白质统称为肌动蛋白结合 蛋白 (ActinGbindingproteins,ABPs)。表6G2G1列出了目前发现的几类典型的 ABPs 和它们的主要作用。
典型肌动蛋白结合蛋白的作用
自然界中存在许多影响微丝聚合或解聚的毒素。细胞松弛素 B (CytochalasinB, CB) (图6G2G2)是真菌中含有的一种生物碱毒素,最初由英国医生 W在 1967年发现并分离出来。研究表明:细胞松弛素 B使微丝解聚的机制可能是通过结合 于 F-actin形成过程中增长速度较快的正端、阻止 G-actin的加入而实现的。利用这种毒素可以溶解微丝使细胞质流动性更强的特点,研究人员在卵母细胞中注入细胞松 弛素 B,从而使克隆技术中的细胞核移除步骤更容易完成。相反于细胞松弛素 B 阻止 微丝形成的作用,鬼笔环肽 (Phalloidin)是存在于毒伞蘑菇 (Amanitaphalloidesor thedeathcap)中的一种阻止微丝解聚的毒素。作为一种二环七肽,鬼笔环肽可结合于 组成 F-actin的单体连接界面,从而使相邻的单体紧紧锁在一起,致使微丝结构更加 牢固而不能解聚。该毒素若经肠外途径进入人体,则会引起因肝细胞大量死亡而导致 急性肝衰竭的中毒症状 (图6G2G3)。然而,研究人员利用鬼笔环肽与 F-actin的结合 力远大于与 G-actin结合力的特点,使用荧光标记的鬼笔环肽定位细胞内的微丝结构, 实现对这一类型细胞骨架的动态监测。
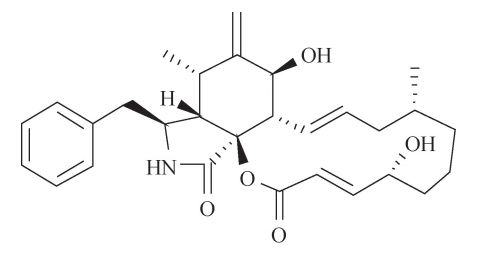
细胞松弛素 B的化学结构
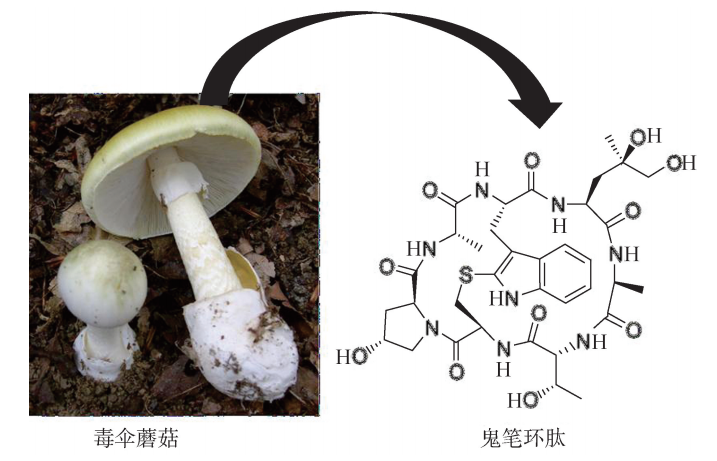
毒伞蘑菇及其破坏微丝解聚的有毒成分鬼笔环肽
(二) 微丝的装配 人体细胞能够在游走或受压条件下发生大的形状改变,是依赖于由球形肌动蛋白 单体组装而成的纤维状微丝结构可以在调控信号的作用下,不断发生聚合和解聚,从 而使形成的微丝在长度、直径上持续改变,促使其编织而成的网格结构在拼接-溶解 之间不断转化的过程。利用肌动蛋白单体聚合成微丝的过程会发生黏滞度和沉降系数 的改变,以及荧光标记的单体聚合为丝状纤维过程的荧光激发光谱会发生变化的特点,研究人员可以通过使用黏滞计、超速离心机、以及荧光分光光度计对于肌动蛋白单体 的动态聚合过程进行监测与分析。
体外实验的数据表明,肌动蛋白单体聚合成微丝的过程可分为以下三期:成核期 (Nucleationphase)、延长期 (Elongationphase)、稳定期 (Steadyphase)。在聚合起 始阶段,三个或四个结合有 ATP的 GGactin形成一个寡聚体 (Oligomers),成为之后 聚合体延长的 “种子”或 “核”,所以该阶段被命名为 “成核期”。在随后发生的 “延 长期”,更多的结合有 ATP的 GGactin分别从寡聚体的两端,按照大结构域在内侧、小 结构域在外侧的方式不断地加入进来,使其长度快速延长。实验观察到,纤维两端加 长的速度不同,其中速度较慢的一端,也是含有 ATP结合位点的裂隙朝向的一端称为 “负端”(Minusend),速度较快的相反一端称为 “正端”(Plusend)(图6G2G4)。在透 射电子显微镜下观察到的微丝结构,因有肌凝蛋白结合在 FGactin上,所以呈现出类似 羽毛箭 的 形 状。 其 箭 头 一 端 (Pointedend) 经 鉴 定 为 FGactin 的 负 端, 而 箭 尾 端 (Barbedend)则为正端 (图 6G2G5)。在 ATPGGGactin 不 断 聚 合 为 FGactin 的 过 程 中, ATP水解后形成的 ADPGGGactin也不断离开聚合体,当聚合速度与解聚速度相当时, FGactin的形成进入 “稳定期”,纤维的长度保持动态恒定。微丝形成过程中的这种边聚 合 (主要发生在正端)、边解聚 (主要发生在负端),使纤维朝向正端延长的动态行为, 也形象地称为 “踏车行为”(Treadmilling)(图6G2G6)。
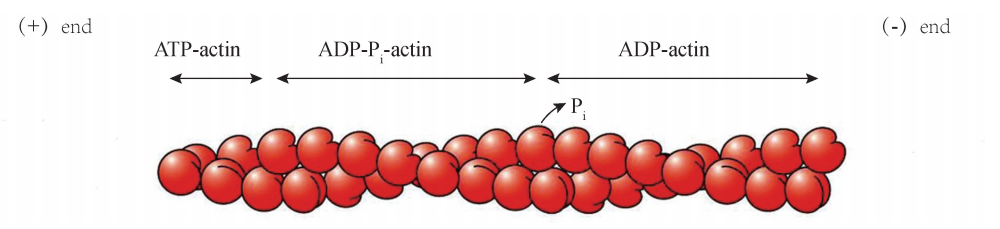
图6G2G4 肌动蛋白按照特定顺序聚合成微丝
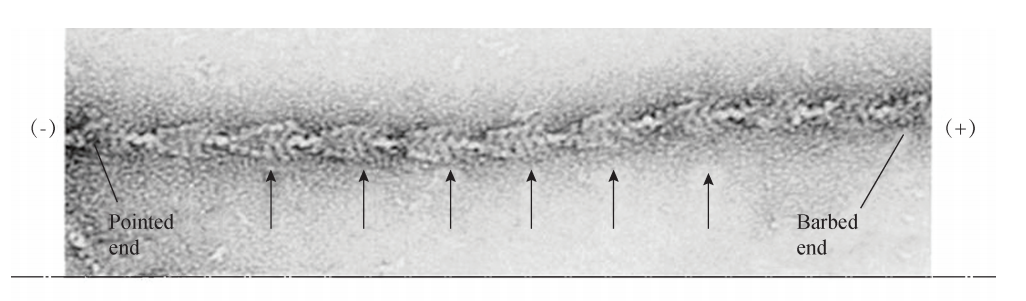
图6G2G5 透射电镜下结合了肌凝蛋白的微丝结构像一支羽毛箭
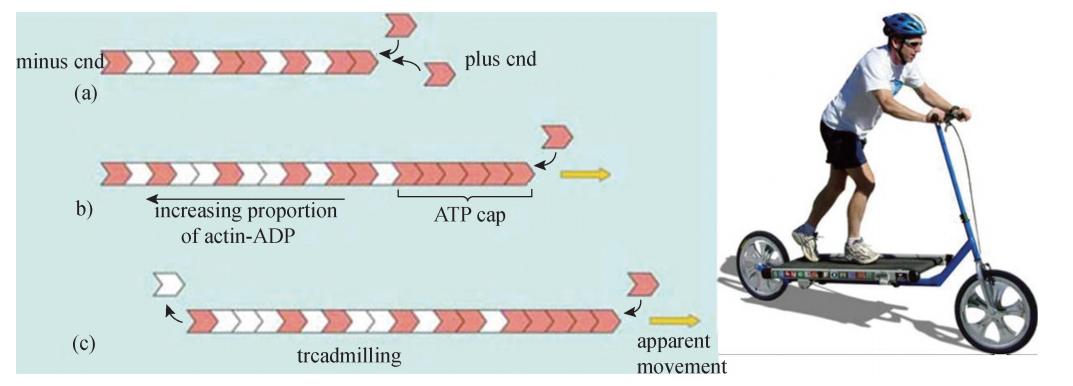
图6G2G6 肌动蛋白聚合成微丝过程中的 “踏车行为”
二、 微丝的生理功能 肌动蛋白丝或微丝在细胞质中不仅起到支撑细胞结构的作用,同时也在肌肉细胞 收缩、细胞迁移、有丝分裂、囊泡转运、信号转导方面发挥重要的功能。 1 构成细胞微绒毛结构和应力纤维 在消化系统的小肠组织中,上皮细胞朝向肠 腔的表面布满了像头发一样的微绒毛 (Microvilli)结构 (图6G2G7)。它们是由细胞质 膜向外突出形成的皱褶状结构,极大增加了细胞表面积,有利于营养物质在小肠内充 分吸收。显微镜下可以看到组成微绒毛结构的核心结构是集结成束的微丝细胞骨架 (图6G2G8)。除小肠上皮细胞外,血液系统的白细胞和女性生殖系统的卵细胞表面也存 在微绒毛结构,其功能分别为促进白细胞迁移和协助精子与卵细胞的融合过程。
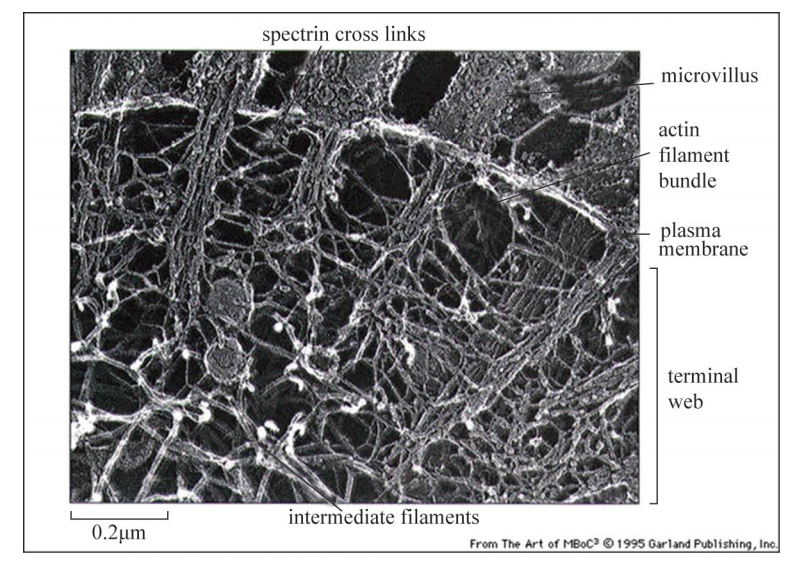
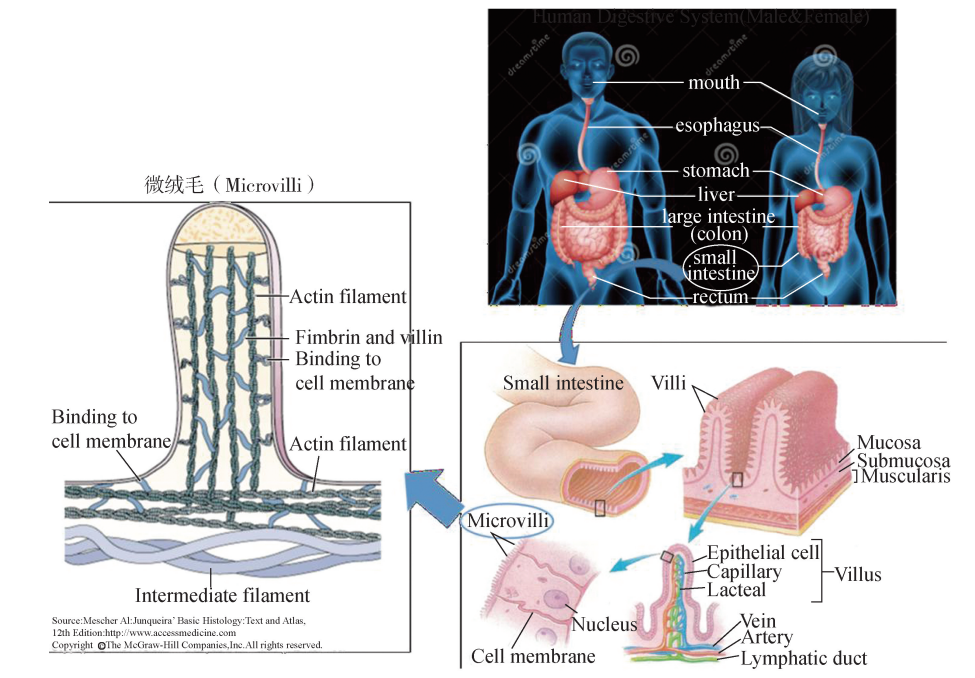
图6G2G8 人体消化系统器官小肠内表面的微绒毛结构构成
微丝还可以在两种肌动蛋白结合蛋白 (肌球蛋 白Ⅱ和α辅肌动蛋白)的辅助下,集结成具有收缩 能力的应力纤维 (Stressfibers) (图6G2G9)。这种 结构存在于体内身处机械压力环境中的非肌肉细胞 中, 比 如, 参 与 伤 口 愈 合 的 成 纤 维 细 胞 (Fibroblasts) 和 血 管 内 皮 细 胞 (Endothelial cells),也可以在体外生长于玻璃或塑料坚硬表面 的培养皿中的细胞内观察到。应力纤维还可以通过 参与细胞 膜 上 黏 着 斑 (Focaladhesions) 的 形 成, 实现 细 胞 与 细 胞 外 基 质 (Extracellular matrix; ECM)之间的连接。
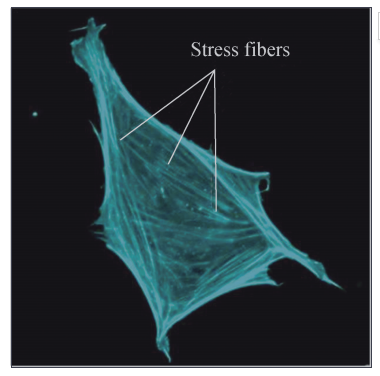
图6G2G9 荧光染色的应力纤维
2 微丝参与肌肉收缩 肢体的行动是通过运动系统中骨骼肌组织的收缩与舒张来 实现的。组成骨骼肌的细胞因呈细长纤维状,因此得名肌纤维 (Musclefibers) (图6G 2G10)。骨骼肌收缩的基本结构单位———肌小节,主要成分是肌原纤维,肌原纤维包含 由微丝组成的细纤维 (Thinfilaments)和肌球蛋白组成的粗纤维 (Thickfilaments)。 当命令收缩的信号传入肌纤维后,本身具有 ATP酶活性的肌球蛋白的头部水解 ATP, 释放的能量使得其头部蛋白构象改变,与微丝结合并形成交联桥。接下来,肌球蛋白 朝向肌小节的中心处弯曲,使粗、细纤维发生相对滑动从而使肌小节长度变短,肌肉收缩,整个收缩过程通过粗、细纤维之间的相对滑动来实现,而两类纤维的绝对长度 不变 (图6G2G11)。
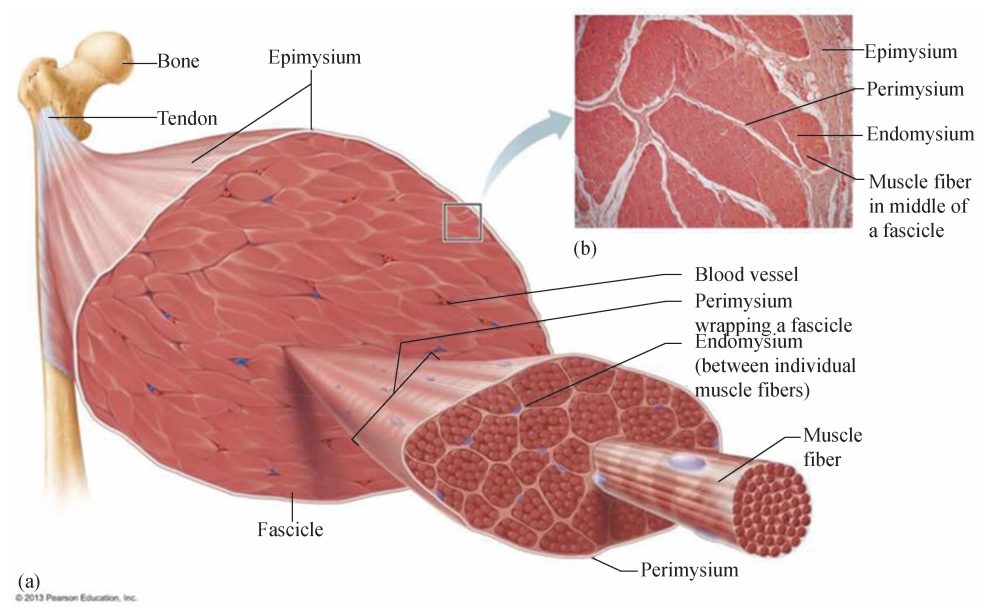
图6G2G10 肌肉组织 (骨骼肌)和肌纤维
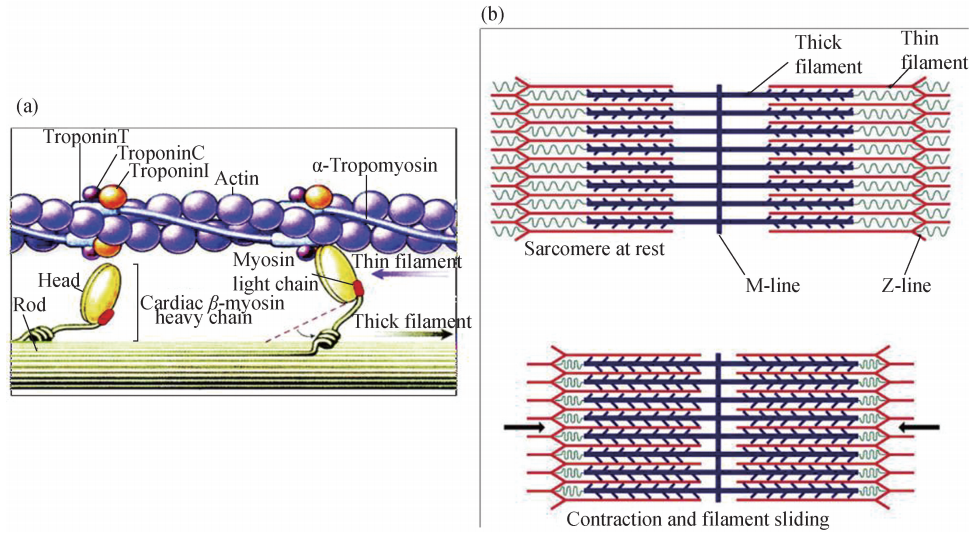
图6G2G11 肌小节中粗、细纤维相互作用模型 (a)及其引发的肌肉收缩机制 (b)
这就是著名的 “肌丝滑行学说”,该学说最初是在1953年由当时任麻省理工学院 的博士后研究人员的英国分子生物学家 Hugh Huxley,在综合了他与同事 Emmeline JeanHanson的研究成果的基础上提出的。 3 微丝参与细胞迁移运动 人体组织内的某些类型的细胞具有迁移功能,比如, 执行伤口愈合功能的成纤维细胞、发育中的神经元、具有吞噬异物功能的巨噬细胞。 这些细胞 的 迁 移 功 能 是 以 微 丝 网 络 形 成 的、 向 某 一 特 定 方 向 突 起 的 丝 状 伪 足 (Filopodia)结构为基础的。在特定信号因子,如生长因子的指引下,微丝首先在其结 合蛋白的协助下,朝迁移方向聚合成束,形成细胞膜表面、突起的伪足结构,然后伪 足部分与细胞附着的介质,如细胞外基质或培养皿之间形成黏着斑结构。由于此结构 的形成产生机械张力,与伪足相反侧的细胞尾部的黏着斑结构解体,继而更多的微丝 聚合发生在细胞头部,使伪足结构得到延长,尾部再发生微丝解聚与介质脱离,循环 往复,实现细胞向特定方向的迁移行为 (图6G2G12)。
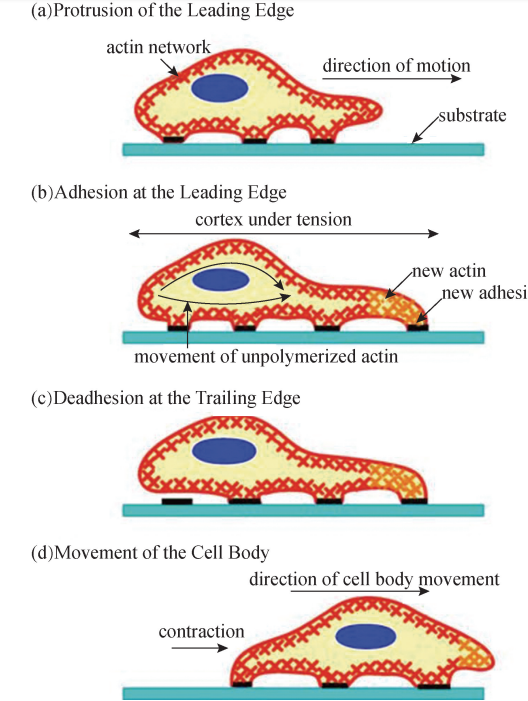
图6G2G12 微丝在细胞迁移中的作用
4 微丝参与细胞有丝分裂 一个亲代细胞的遗传物质经过复制后,需要平均分 配到两个子细胞中去,完成一个有丝分裂细胞周期。而这一周期重要的一步,是通 过由微丝和肌球蛋白Ⅱ,以及其他肌动蛋白结合蛋白 (如 Anillin)组装成的收缩环 (Contractilering)来完成的。收缩环在亲代细胞的中间位置、细胞质膜的内侧面组装 形成,并且形成后的收缩环结构与细胞质膜相连。当肌球蛋白Ⅱ启动收缩环收缩时, 细胞质膜在收缩张力的作用下被 “勒”出一道分裂沟,继而亲代细胞被均分成两个子细胞,完成有丝分裂过程 (图6G2G13)。
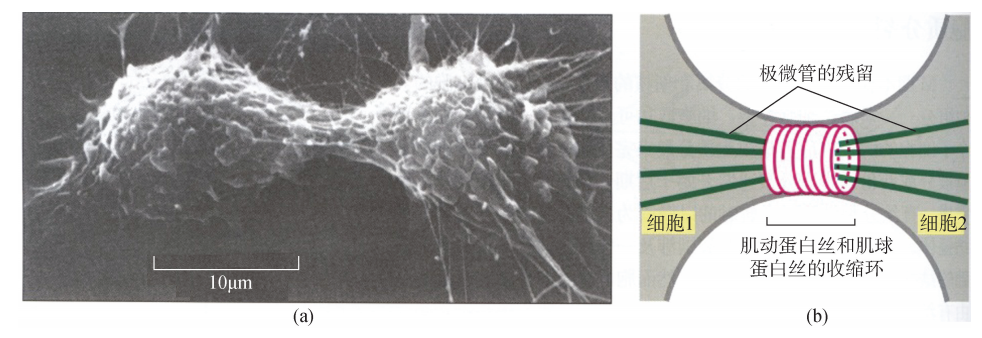
有丝分裂过程中的收缩环
5 微丝参与细胞内的囊泡转运 微丝与另一种类型的细胞骨架———微管组成可以 进行囊泡运输的轨道系统,在特定信号分子的调控下,完成囊泡内物质有序运输。 6 微丝参与细胞内的信号转导 微丝通过一组特异的微丝结合蛋白 (如黏着斑蛋 白、踝蛋白、α-辅肌动蛋白)与位于细胞膜上的受体蛋白整合素 (又名整联蛋白,InG tegrins)相连接,整合素可以通过感知细胞外基质中的机械信号 (如压力、剪切力改 变)或化学信号 (整合素的配体,如胶原蛋白、纤维连接蛋白分子等细胞外基质蛋白 质),引发所连微丝的聚合或解聚过程,从而影响下游信号分子的激活状态,达到调控 细胞形状、迁移和分裂增殖的目的。


