本章节视频:
本章节内容:
随着社会发展,近年来,现代医学科学也有了长足的进步,而重症患者营养不良的发生比率却未见下降。究其原因主要有社会人口老龄化;医学水平的提高使得重症患者生命延长,使病情更加复杂迁延;应激时的无氧代谢使得各种营养底物难以利用;严重的病理生理损害(意识、体力、消化器官功能)妨碍重症患者进食;部分慢性患者往往有长期的基础疾病消耗;病理性肥胖患者增多等。因此对重症患者进行正确、合理的营养评估并做好营养支持极其重要。每一位进入重症监护病房的患者都需要进行营养状态评估,以了解是否有营养不良的风险。给予正确有效的营养支持对患者康复起重要作用。
第一节 概述
一、急危重症患者的代谢特点
急危重症患者机体处于应激状态,交感神经系统兴奋性增强,体内促进分解代谢的激素分泌增加,而胰岛素的分泌减少或正常。基本代谢变化包括内分泌改变与糖代谢紊乱、能量代谢增高、蛋白质分解代谢加速、脂肪代谢紊乱、维生素代谢变化、电解质紊乱和胃肠功能改变。
(一)内分泌改变与糖代谢紊乱
机体在创伤、手术、感染等情况下发生应激反应。一方面,应激反应使体内儿茶酚胺、糖皮质激素、胰高血糖素、甲状腺素的分泌增加,糖原分解加强,糖异生明显活跃,葡萄糖生成增加;另一方面,和饥饿时的代谢紊乱情况不同,危重症患者糖的产生成倍增加,而胰岛素分泌减少或相对不足,机体对胰岛素的反应性降低,使胰岛素不能发挥正常作用,刺激组织对葡萄糖的摄取和利用,这种现象称为胰岛素抵抗。出现胰岛素抵抗现象,即无论血浆胰岛素水平如何,原先对胰岛素敏感的组织变为不敏感,使细胞膜对葡萄糖的通透性降低,组织对葡萄糖的利用减少,进一步促成高血糖反应。机体呈高血糖状态。在MODS的早期血糖明显升高,而高糖血症又加重机体的应激反应,形成恶性循环。
(二)能量代谢增高
静息能量消耗(REE)增加,是危重症患者能量代谢的基本特征。REE是患者卧床时热量需要的基数。
基础能量消耗(BEE)指人体在清醒而极度安静的状态下,不受肌肉活动、环境温度、食物和精神紧张等因素影响时的能量代谢。REE约为BEE的1.1倍左右。高代谢是指BEE在正常值的110%以上。创伤后,基础代谢率可增加50%~150%,最高可达正常时的2倍。Wilmore(1980)的研究表明,BEE增高的程度随创伤/感染的原因及程度而异。烧伤面积达60%时,能量需要量增加到原正常值的210%;腹腔感染时,增加到150%左右。机体呈高代谢状态,其程度与危重患者创伤/感染的严重程度成正比。
(三)蛋白质分解代谢加强,肌肉组织释放氨基酸
蛋白质作为功能和结构组织存在于人体,和饥饿时不同,创伤/感染后蛋白质丢失及分解呈进行性代谢增加。此消耗用于维持急性应激反应所需的蛋白质与能量。而总体上蛋白质合成降低,这种分解代谢的持续难以被一般外源性营养所纠正,称为自身相食现象。
血中氨基酸谱发生变化,氨基酸谱紊乱。芳香族氨基酸(AAE)和含硫氨基酸的浓度明显升高,支链氨基酸(BCAA)的血浆水平正常或降低。BCAA/AAE比值明显下降。
研究发现,当机体氮丢失量达到150~320g(占蛋白质的8%~17%),与机体衰弱和死亡率升高成正相关。支链氨基酸在肝外器官氧化功能、尿氮排出量增加,机体出现负氮平衡。
(四)脂肪动员、分解代谢增强
脂肪分解氧化是体内主要的供能方式,通常状态下,约30%的热量由脂肪提供,每克脂肪组织能提供热量33.5 kJ。与饥饿时的营养障碍有所不同,在创伤/感染等应激状态下,由于储存的糖原很快被耗尽,脂肪被动员供能。脂肪分解加速,周围组织利用脂肪的能力受损,即脂肪分解产物不能得到充分利用,血中游离脂肪酸、三酰甘油及甘油浓度增高,常出现高三酰甘油血症。但酮体的形成则根据创伤的种类和严重程度而有所变化。通常严重休克、创伤和感染后,酮体生成降低或缺乏。轻度创伤或感染时,酮体生成则稍增加,但往往低于非应激的饥饿状态时的酮体水平。
(五)严重创伤或感染可导致水、电解质与酸碱平衡失调
应激反应时抗利尿激素和醛固酮分泌增多,有水钠潴留的倾向。严重的可导致水中毒。
(六)维生素代谢改变
创伤或感染后常伴有维生素C缺乏,可导致伤口愈合延迟和白细胞数量下降。
(七)胃肠道功能改变
有研究称肠道是创伤应激反应的中心器官。危重患者的胃肠功能发生许多改变,如消化腺分泌功能受抑制,胃肠功能障碍,蠕动减慢,患者出现食欲下降、厌食、腹胀等情况;危重患者常并发应激性溃疡;因禁食和使用广谱抗生素,导致肠道菌群失调,肠道屏障功能障碍和肠源性细菌移位。此外,肠黏膜急性损伤后细胞因子的产生可导致SIRS和MODS。对肠道黏膜屏障损伤与肠道细菌移位的防治效果研究,成为目前危重症患者营养支持领域探讨的核心问题之一。
二、营养状态的评估
营养状态评估是通过人体组成测定、人体测量、生化检查、临床检查及多项综合营养评定方法等手段,判定人体营养状态,确定营养不良的类型及程度,评估营养不良所致后果的危险性,并监测营养支持疗效的方法。
完整的营养评估包含:①测量身高、体重、体重指数(BMI);②与营养不良相关的体征。如脸色苍白、水肿、腹水等;③生化检查,包括血清蛋白、胆固醇、三酰甘油、低密度脂蛋白胆固醇(LDL,cholesterol),以及血红蛋白、红细胞压积、MCV、淋巴细胞计数、测量氮平衡等指标;④询问饮食习惯、酗酒、体重变化等。
(一)营养状态的测定方法
1.人体测量 包括身高、体重、体重指数、皮褶厚度、上臂围等指标的测量。
(1)体重测量(BW):体重是营养评定中最简单、直接而可靠的测量指标,它可代表脂肪和蛋白质这两大类储能物质的总体情况,体重改变可从总体上反映人体营养状况。测定体重时须保持时间、衣着、姿势等方面的一致,应选择晨起空腹,排空大小便后测定。同时,应注意水肿、腹水、应用利尿剂等因素的影响。体重的常用指标有:①实际体重占理想体重(IBW)百分比:即实际体重/IBW×100%,该值在±10%之间为正常;②体重改变(%):体重改变(%)=[通常体重(kg)-实测体重(kg)]÷通常体重(kg)×100%。若3个月内减少10%的体重,或一个月内减少5%体重,提示负氮平衡,患者处于营养不良的风险中;若患者的体重比标准体重低20%,提示营养不良。体重变化虽然可以反映营养状态,但是要排除患者缺水或水肿等因素的影响;③体重指数(body mass index,BMI):BMI=体重(kg)/身高2(m2)。BMI是反映蛋白质热量营养不良及肥胖症的可靠指标。BMI正常值为18.5~24,若BMI>24为超重,BMI小于18.5为慢性营养不良,BMI<14的危重患者存活的可能性很小,身高是反映人体营养状态的一项基本指标,但是它不像体重可以反映短期身体营养状况的变化,它需要长时间的监测才能说明问题。
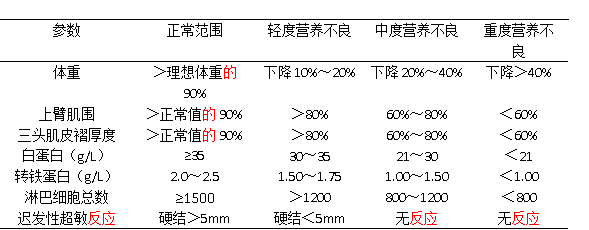
(2)皮褶厚度:人体皮下脂肪含量约占全身脂肪总量的50%,通过皮下脂肪含量的测量可以推算体重总量,并间接反映热量代谢变化。皮褶厚度的测定部位有上臂肱三头肌、肩胛下角部、腹部、髂嵴上部等。临床上常用三头肌皮褶厚度(triceps skinfold thickness,TSF)测定。正常参考值男性为10.5mm,女性为13.5mm。实测值在正常值的90%以上为正常,80%~90%为脂肪轻度亏损;60%~80%为中度亏损;<60%为重度亏损。
(3)上臂围(AC)和上臂肌围(AMC):测量上臂围时,被测者上臂自然下垂,取上臂中点,用软尺测量上臂的周径,男性<23cm,女性<22cm表示有营养消耗;AMC=AC-3.14×TSF。其可间接反映体内蛋白质储存水平,代表体内骨骼肌量,它与血清白蛋白水平相关。研究发现,当血清白蛋白<2.8g/L时,87%的患者出现AMC减小。参考值男性为24.8cm,女性为21.0cm。实测值在参考值的90%以上为正常,80%~90%为轻度营养不良,60%~80%为中度营养不良,<60%为重度营养不良。男性AMC<15cm,女性<14cm表示骨骼肌有明显消耗。
2.生化实验室检查
(1)蛋白质测定:血红蛋白(Hb)、血清蛋白(Alb)、肌酐身高指数(CHI)、氮平衡(NB)及血浆氨基酸谱测定等方法。
(2)细胞免疫功能评定:细胞免疫功能在人体抗感染中起重要作用。蛋白质缺乏常伴有细胞免疫功能的损害,从而增加了患者术后感染和死亡的几率。①总淋巴细胞计数(TLC):是评价细胞免疫功能的简易方法。计算公式为TLC=淋巴细胞百分比×白细胞计数。TLC>20×108/L时为正常,(12~20)×108/L时为轻度营养不良,(8~12)×108/L时为中度营养不良,<8×108/L时为重度营养不良。②皮肤迟发性超敏反应(SDH):将不同的抗原在前臂屈侧面不同部位进行皮下注射,量为0.1ml,48小时后测量接种皮肤硬结直径,若大于5mm为正常。常用试验抗原包括链激酶/链道酶、流行性腮腺炎病毒素、白念珠菌提取液、植物血凝素和结核菌素试验。
3.综合营养评定 临床目前多采用综合性营养评定方法,以提高灵敏性和特异性。常用指标包括预后营养指数、营养评定指数、主观全面评定和微型营养评定。若判断患者有无营养不良,应对其营养状况进行全面评价(表11-1)。
表11-3简易营养评定法
(二)能量与蛋白质需要量的评估
1.能量需要量评估 一般患者能量需要量为25~35kcal/(kg·d)。不同个体、不同病情及不同活动状态下的能量需要量差别较大,评估时要综合考虑。目前常采用Harris-Benedict公式计算基础耗能(BEE),并且以BEE作为参考指标计算实际耗能(AEE)。其中 BEE与AEE的单位均为千卡(kcal),W为体重(kg),H为身高(cm),A为年龄(岁),AF为活动系数,IF为应激系数,TF为体温系数。
男性BEE=66.5+13.7W+0.5H-6.8A
女性BEE=66.5+9.6W+1.7H-4.7A
AEE=BEE×AF×IF×TF
2.蛋白质需要量评估 利用氮平衡来评价蛋白质的实际水平及需要量。若氮摄入量大于排出量,为正氮平衡,反之为负氮平衡。氮平衡的公式为:
氮平衡(g/d)=摄入氮量(g/d)-[尿氮量(g/d)+3]
知识链接
国内外营养支持的发展史
国外的营养支持研究从1716年W.Harvey发现了人体循环系统开始,到了1831年,T.Latta对霍乱患者进行静脉盐水治疗获得成功;1887年Handerer对出血性休克患者进行静脉葡萄糖输注;1911年Kansch对外科术后患者静脉滴注葡萄糖;1959年Francis Moore提出NPC:N为150:1;1961年Arvid Wretlind首先发明脂肪乳Intralipid;1967年提出全静脉营养(TPN)概念;到了1970年,美国Scribner与法国Solassol提出人工胃肠概念,提出全胃肠外营养(TPN)与全胃肠内营养(TEN)。
相关组织的建立:1979年欧洲肠外及肠内营养学会成立,《临床营养杂志》 (CLINICAL NUTRITION)创刊;1977年美国肠外及肠内营养学会成立,《肠外与肠内营养杂志》(JPEN)创刊;1979年,日本《输注与营养杂志》(JJPEN)创刊。
我国的临床营养支持研究始于1960年,在上海中山医院开始探索外科患者营养代谢与营养治疗;1970年南京军区总院与北京协和应用TPN(葡萄糖与蛋白水解液)进行营养治疗获得成功;1980年国内生产营养型氨基酸、治疗型氨基酸、脂肪乳剂、维生素制剂、微量元素制剂,临床营养概念在国内建立;1990年,临床营养概念在国内广泛普及,临床营养治疗开始为广大临床医生所接受。部分大型/综合性医院成立临床营养中心/临床营养小组。
相关组织的建立:1985年,全国外科营养支持学会会议;1990年,中华医学会外科学会外科营养支持学组成立;1993年:《中国临床营养杂志》 ;1994年:《肠外与肠内营养》。
第二节 营养支持方式
营养支持是指经口、肠内管饲及肠外等方式提供营养,目的是提供适当营养以支持人体所需,减少合并症,促进康复等。根据营养素补充途径不同,临床营养支持分为肠外营养(PN)与肠内营养(EN)两种方法。肠外营养主要通过外周或中心静脉途径给予机体营养液;而肠内营养主要通过口服或喂养管经胃肠道途径给予机体营养物质。80%的患者可耐受完全肠内营养(TEN),另外10%可接受PN和EN混合形式营养,其余10%不能应用肠内营养的选择完全肠外营养(TPN)。特别是重症患者,肠内营养不耐受的发生率高于普通患者,对于合并肠功能障碍的重症患者,肠外营养支持是其综合治疗的重要组成部分。
一、肠内营养
(一)适应证
胃肠功能恢复、能耐受肠内营养且实施肠内营养不会加重病情者均应尽早创造条件实施肠内营养支持。
1.需低渣饮食的手术患者。
2.胃肠道疾病 如短肠综合征、胃肠道瘘、炎性肠道疾病 、胰腺疾病等。
3.肠道外疾病 如肿瘤化疗/放疗的辅助治疗、围手术期患者的营养补充、烧伤与创伤、中枢神经系统紊乱、心血管疾病等。
4.TPN向口服营养的过渡期。
(二)禁忌证
1.完全性机械性肠梗阻或严重麻痹性肠梗阻、严重肠道缺血,肠内营养可能引起肠管过度扩张,肠道血运恶化,甚至肠坏死、肠穿孔。
2.严重腹胀或腹腔间室综合征,肠内营养可能增加腹腔内压力,使呼吸循环等功能进一步恶化及导致反流误吸。
3.顽固性呕吐、严重腹泻、腹泻经一般治疗无改善、严重吸收不良综合征。
4.中量至大量消化道出血。
5.严重腹腔内感染。
6.多发性肠瘘。
(三)输入途径
途径包括口服、鼻胃管、鼻十二指肠管、鼻空肠管、胃造口、空肠造口等多种方式。具体途径选择取决于疾病情况、喂养时间长短、患者精神状态及胃肠道功能。
1.口服途径 最经济、最简便、最安全的投给方式,且符合人体正常生理过程。
2.鼻胃管、鼻十二指肠管、鼻空肠管途径 适用于营养治疗不超过4周的患者,最理想的治疗途径是放置细鼻胃管。此途径简单易行,是目前临床最常采取的给养方式。
3.胃造瘘 适用于较长时间不能经口进食者,此方式接近正常饮食,方法简便。操作方法有两种,一种方法为剖腹胃造口术;一种为经皮内镜辅助的胃造口术(PEG)。PEG是近几年发展起来的新型胃造口方法,具有不需剖腹和麻醉,操作简便、创伤小等优点。
4.空肠造瘘 优点很多,是目前临床肠内营养治疗应用最广泛的途径之一。其优点为:①呕吐和误吸的发生率低;②肠内营养与胃肠减压可同时进行,对肠外瘘及胰腺疾病患者尤为适宜;③可长期放置喂养管,尤其适用需长期营养治疗的患者;④患者可同时经口进食;⑤患者无明显不适感,心理负担小,机体活动方便,生活质量好。
(四)肠内营养的输注方式
可采取间歇给予和连续给予的方式。间歇给予即将肠内营养液分次喂养,每日4~7次,10~20分钟内要输注200~400ml;连续给予,即24小时内利用重力或营养泵将肠内营养剂持续输注到胃肠道的方式。
(五)常见并发症及护理
EN的主要并发症为感染性并发症、机械性并发症、胃肠道并发症和代谢并发症。
1.感染性并发症 其中吸入性肺炎是最常见的感染性并发症;误吸导致的吸入性肺炎是EN最常见和最严重的并发症。护理措施有:一旦发生误吸应立即停止EN,促进患者气道内的液体与食物微粒排出,必要时应通过纤维支气管镜吸出,遵医嘱应用糖皮质激素抵抗肺水肿及应用有效抗生素治疗感染。
2.机械性并发症
(1)黏膜损伤:可因置管操作过程或喂养管对局部组织的压迫而引起黏膜水肿、糜烂或坏死。护理时护士应选择直径适宜、质地柔软且有韧性的喂养管,熟练掌握操作技术,置管时动作轻柔。
(2)喂养管堵塞:最常见的原因是膳食残渣或粉碎不全的药片黏附于管腔壁,或药物与膳食不相溶形成沉淀附于管壁所致。发生堵塞后可用温开水低压冲洗,必要时也可借助导丝疏通管腔。
(3)喂养管脱出:喂养管固定不牢或患者躁动及严重呕吐均可导致喂养管脱出,不仅使EN不能顺利进行,而且经造瘘置管的患者还有引起腹膜炎的危险。护士置管后应妥善固定导管,加强护理与观察,严防导管脱出,一旦喂养管脱出应及时重新置管。
3.胃肠道并发症
(1)恶心、呕吐与腹胀:接受EN的患者均有,其中10%~20%可发生恶心、呕吐与腹胀,主要见于营养液输液速度过快、乳糖不耐受、膳食口味不耐受及膳食中脂肪含量过多等。护士应根据情况减慢输注速度、加入调味剂或更改膳食品种等。
(2)腹泻:是EN最常见的并发症,见于低蛋白血症和营养不良时小肠吸收力下降;乳糖酶缺乏症者,应用含乳糖的肠内营养膳食;肠腔内脂肪酶缺乏,脂肪吸收障碍;应用高渗性膳食;营养液温度过低及输注速度过快;同时应用某些治疗性药物等。一旦发生腹泻应首先协助医生查明原因,针对病因进行处置,必要时可遵医嘱对症给予止泻剂。
4.代谢性并发症 高血糖和低血糖都是最常见的代谢性并发症。高血糖常见于高代谢状态的患者、接受高碳水化合物喂养者及接受糖皮质激素治疗的患者;而低血糖多发生于长期应用肠内营养突然停止时。对于接受EN的患者应加强对其血糖的监测,出现血糖异常时应及时报告医生进行处理。另外,停止EN时应逐渐减量,避免突然停止。
二、肠外营养
(一)适应证
1.患者有肠道梗阻者。
2.肠道功能异常,如肠道吸收功能障碍、短肠综合征、小肠严重疾病、严重腹泻或顽固性呕吐大于1周者。
3.患者患重症胰腺炎、肠麻痹未恢复时。
4.大面积烧伤、严重复合伤或感染等机体处于高分解代谢状态。
5.严重营养不良伴有胃肠功能障碍,无法耐受肠内营养者。
6.大手术或严重创伤的围手术期。
7.患者有肠外瘘。
8.炎性肠道疾病病变活动期治疗的患者。
9.严重营养不良的肿瘤患者围手术期治疗时。
10.患者肝肾等重要脏器功能不全时的支持治疗。
(二)禁忌证
1.早期复苏阶段血流动力学不稳定或存在严重水、电解质与酸碱失衡的患者。
2.严重肝功能障碍的患者。
3.急性肾功能障碍患者。
4.严重高血糖未控制的患者。
(三)肠外营养的输入途径
输入途径包括中心静脉营养支持(CPN)和周围静脉营养支持(PPN)两种途径。
1.CPN 是指全部营养要素通过中心静脉补充的营养支持方式。适用于肠外营养超过2周者,营养液渗透压高于800~900mmol/L。主要通过颈内静脉、锁骨下静脉或经外周的中心静脉(股静脉)插管 。
2.PPN 是指通过外周静脉导管全面输送蛋白质和热量的方法。适用于病情轻、用量少的短期(2周内)肠外营养者,营养液渗透压低于800~900mmol/L;中心静脉置管禁忌或不可行者;导管感染或有脓毒症者。
(四)供给方式
1.全营养混合液输注 是目前临床最常用的营养液输注方式。全营养混合液(TNA)输注法,又称为“全合一”营养液输注法,就是将每天所需的营养物质在无菌条件下按次序混合输入由聚合材料制成的输液袋或玻璃容器内再输注,此方法保证了所提供的营养物质的完整性和有效性。
2.单瓶输注 在无条件应用全营养混合液供给方式时可采用单瓶方式输注营养液。缺点是各营养素非同步输注而造成某些营养素的浪费或负担过重。
(五)常见并发症及其护理
1.机械性并发症
(1)导管堵塞:是PN最常见的并发症之一。护士在巡视过程中应注意调整输液速度,以免因凝血而发生导管堵塞。输液结束时应根据患者病情及出凝血功能状态使用生理盐水或肝素溶液进行正压封管。
(2)置管操作并发症:如气胸、血胸、皮下气肿、血管与神经损伤等。护士的熟练操作技术与流程规范,操作过程动作轻柔等可减少此类机械性损伤。
(3)空气栓塞:可发生在置管、输液及拔管过程中。护士置管时应让患者头低位,操作者严格遵守操作规程,对于清醒患者应嘱其屏气;输液过程中加强巡视,液体输完应及时补充,最好应用输液泵进行输注;导管护理时应防止空气经导管接口部位进入血液循环,拔管引起的空气栓塞主要是由于拔管时空气可经长期置管后形成的隧道进入静脉;拔管速度不宜过快,拔管后应密切观察患者的反应。
2.感染性并发症 是PN最常见、最严重的并发症。感染的主要原因是插管时污染伤口、输入器具或溶液污染和静脉血栓形成。导管引起局部或全身性感染是肠外营养主要的并发症:常见化脓性静脉炎,严重者可引起脓毒症,并且发生局部和全身真菌感染的机会较多。应严格无菌操作,操作动作要轻柔,选择合适的导管,固定的导管不能随意拉出或插进,避免从导管抽血或输入血液制品,液体输入要现用现配,输液袋每天更换,出现原因不明的寒战、高热应拔出导管,并对导管尖端进行培养,根据致病菌种类进行针对性治疗。
3.代谢性并发症 患者可发生电解质紊乱,如低钾血症、低镁血症;低血糖和高血糖等。因此,应在PN时严密监测电解质及血糖与尿糖变化,及时发现代谢紊乱,并配合医生实施有效处理。


