一、盐类的水解
我们知道水溶液的酸碱性主要取决溶液的氢离子浓度和氢氧根离子浓度的相对大小。
在NaAC、Na2CO3、NH4Cl、等盐类物质,在水中即不能解离出氢离子,也不能解离出氢氧根离子,它们的水溶液似乎都应该是中性的,事实并非如此。
实验结果告诉我们,强酸强碱形成的盐,在水溶液是中性(NaCl pH=7);强酸弱碱形成的盐,水溶液是酸性(0.1 molL-1NH4Cl pH=5.20);强碱弱酸形成的盐,水溶液是碱性(0.1 molL-1 Na2CO3pH=11.62)。为什么它们溶于水时会有酸碱性呢?这就是因为这些盐解离出来的弱酸根离子或弱碱的阳离子跟水解离出来的H+或OH-生成生成弱电解质弱酸或弱碱,从而促进水的解离平衡发生移动,改变了溶液中氢离子和氢氧根离子的相对溶度,使溶液变成非中性的。
我们把在溶液中盐的离子与水解离出来的H+或OH-结合生成弱电解质的反应,叫盐类的水解。
注意:不是所以的盐都会水解的,只有(1)可溶性的盐,(2)同时能解离出弱酸根离子或弱碱阳离子的盐才能水解。下面我们依照形成盐的酸和碱的强弱不同分三种类型。
1、弱酸强碱盐的水解
所谓的弱酸强碱盐是强碱和弱酸反应生成的盐。
为了从本质上来认识弱酸强碱盐的水解,我们常数以NaAC为例来说明。
NaAC水解的离子方程式:

从水解反应式可以看出,由于NaAC解离出的 AC-与水解离出的氢离子结合生成弱电解质HAC,使氢离子溶度小于水解离平衡时的氢离子溶度,因此使水的解离平衡移动向右进行,致使氢氧根溶度大于氢离子溶度,所以水溶液显碱性。
2、弱碱强酸盐的水解
所谓的弱碱强酸盐就是强酸和弱碱反应生成的盐。
我们以NH4Cl为例,这种盐的水解情况和NaAC的水解情况相似,不同的是盐的阳离子NH4+与水解离出的氢氧根生成弱碱,使水的解离平衡向右进行,致使溶液中氢离子溶度大于氢氧根离子溶液,所以水溶液显酸性。
我们看NH4Cl 的水解离子方程式:
![]()
NH4+与H2O 反应产生NH3.H2O这个过程的结果就是产生了一定量的H+使溶液呈弱酸性。
从水解离子方程式看,如果在弱碱强酸盐溶液中加入少量的强酸,那么酸解离出来的H+的量远远超过了水解产生的H+,水解会向左移动,从而抑制了NH4+的水解,这就是少量强酸能抑制强酸弱碱盐的水解。
3、弱酸弱碱盐的水解
这类的盐水解比上述两种盐的水解要复杂,因为盐中的正负离子都要与水解离出的氢离子和氢氧根离子作用,生成弱酸与弱碱。
如NH4AC的水解:
![]()
从水解反应可以看出,由于此类盐解离的阳离子、阴离子分别和氢氧根离子和氢离子氢离子形成弱碱和弱酸,因此这类盐的水解是很强烈的。水解后溶液的酸碱性起决于弱酸、弱碱的相对强弱。由于氨水和醋酸的解离平衡常数一样,因此溶液中氢离子溶度与氢氧根离子溶度相等,pH都是7。
这里应该指出的是,虽然弱酸弱碱盐的水解有时也会使水溶液的pH值是7,但这与强酸强碱的盐的水溶液pH等于7是有本质的差别,弱酸弱碱盐发生水解但由于Ka═Kb所以pH值是7,而强酸强碱是根本不发生水解。
弱酸弱碱盐水解,生成两种弱电解质溶液的酸碱性要比较它们的解离常数Ka、Kb值的大小,当Ka﹥Kb溶液显弱酸性;当 Ka﹤Kb溶液显弱碱性;当Ka═Kb呈中性。
从以上水解反应的产物可以看出,水解后生成的酸和碱,正好是中和反应生成盐时的酸和碱,因此,水解反应是中和反应的逆反应。

二、盐类的水解的应用
在化工生产和科学实验中,水解现象是经常发生的,有时需要防止水解的产生,有时要利用水解。
例如在配制SnCl2等溶液(FeCl3、AlCl3、CuCl2、)时要防止水解,常用盐酸溶液而不用蒸馏水配制,这是因为:
![]()
SnCl2它属强酸弱碱盐,会发生水解反应,在配制溶液时,我们使用HCl,可使水解平衡向左移动,减少SnCl2的水解发生,不致有Sn(OH)Cl↓沉淀产生。
在配制Na2S溶液时、由于Na2S也会发生水解,
我们看Na2S的水解反应方程式:

水解过程中生成H2S逐渐发挥,会使溶液失效。
还有Na2SiO3、Na2CO3、NH4F等溶液不能贮存磨口玻璃塞的试剂瓶中。是因Na2SiO3、Na2CO3会发生水解,使溶液呈碱性,产生OH-,和玻璃反应。而NH4F水解产生HF。HF均能腐蚀玻璃。
如铵盐类氮肥 (NH4+)不能与碳酸钾草木灰(主要成分K2CO3)混合使用。如混施会发生双水解反应:
2NH4Cl+K2CO3==2KCl+H2O+2NH3↑+CO2↑
造成有效成分的损失。
总之,凡是对于我们不利的水解反应,都要尽量的控制和防止。我们可以采用加碱、加酸的方法进行抑制。
水解反应并非对都是不利的。例如
我们可以通过FeCl3、KAl (SO4)2·12H2O等水解作为净水剂,
Fe3+、Al3+水解产生少量胶状的Fe(OH)3、Al(OH)3,它们结构疏松、表面积大、吸附能力强,故能吸附水中悬浮的小颗粒而沉降,从而起到净水的作用。
泡沫灭火器的原理是利用NaHCO3和Al2(SO4)3混合可发生双水解反应。
泡沫灭火器中分别装有Al2(SO4)3和NaHCO3它们的水解反应如下:

Al2(SO4)3水解产生大量的氢离子;NaHCO3水解反应生成大量的氢氧根离子。一但在灭火时,两种溶液混合,这时生成的氢离子和氢氧根离子作用生成水,从而使两个物质水解不断进行,产生大量CO2将胶状Al(OH)3吹出可形成泡沫,喷射在燃烧物体的表面,使燃烧的物质在隔绝空气下熄灭。
我们热水纯碱液清洗油污,
热能促进纯碱Na2CO3水解,产生的[OH-]较多,而油污中的油脂在碱性较强的条件下,水解受到促进,热水清洗油污的比冷水的效果好。
在化工生产和科学实验中,有的是利用水解反应,有时要控制水解,由于水解反应是中和反应的逆反应,一般是吸热,因此为了有利水解反应常采用加热和稀释溶液等办法,为了防止水解,则可以浓缩溶液。
三、盐类水解的离子反应方程式的书写规律:
因为盐类的水解是微弱且可逆的,在书写其水解离子反应方程式时应注意以下几点:
![]()
(2)一般生成物中不出现沉淀和气体,因此在书写水解离子方程式时不标“↓”或“↑”也不将生成物如H2CO3、NH3.H2O等写成其分解产物的形式。
(3)多元弱酸相应的盐水解与多元弱酸的解离一样是分步进行的,每一步水解分别用一个水解离子方程式表示,不能连等,不能合并,每一步的水解程度也与分步解离一样,呈现大幅下降的趋势。
如Na3PO4的水解依次为:
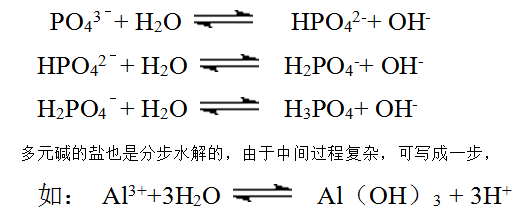
小结:
⒈实质:弱电解质的生成,破坏了水的解离,促进水的解离平衡发生移动的过程。
⒉规律:难溶不水解,有弱才水解,无弱不水解(能发生水解反应的盐必须是可溶性盐;不能水解反应的盐强酸强碱盐,不溶解的盐。
谁弱谁水解,越弱越水解,都弱双水解。(只有弱酸的阴离子或弱碱的阳离子才能与H +或 OH-结合生成弱电解质)
谁强显谁性,同强显中性,弱弱具体定
(强酸弱碱盐水解,溶液呈酸性,pH<7;强碱弱酸盐水解,溶液呈碱性,pH>7;强酸强碱盐不水解,溶液呈中性,pH=7;弱酸弱碱盐水解程度大。酸碱性要比较它们的解离常数Ka、Kb值的大小,当Ka﹥Kb溶液显弱酸性;当Ka﹤Kb溶液显弱碱性;当Ka═Kb呈中性);
越热越水解,越稀越水解。(盐类水解反应是酸碱中和反应的逆过程,吸热反应。是可逆反应,程度很小,一般不能进行到底)


