一、水的解离
水是一种很弱的电解质,它可以发生微弱的解离,它的解离方程式是:
![]()
根据实验测得,在22℃时1L纯水,当解离达到平衡时,只有10-7mol的水分子发生解离。因此水中氢离子溶度和氢氧根离子溶度都是等于10-7molL-1。这样的解离相当在10亿个水分子中,仅有1、2个水分子解离,这时的解离度不超过1.8×10-9,因此在解离平衡计算时我们就可以忽略已解离的水的分子数。
水的解离平衡可以表示如下:
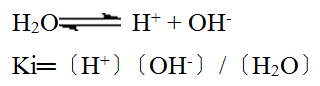
在22℃时1L纯水的质量为1000g,它的物质的量近似为55.5molL-1将这一数值代入的水的解离平衡公式中,得到
〔H+〕〔OH-〕═Ki×〔H2O〕═Ki×55.4═kw
kw═〔H+〕〔OH-〕═〔10-7〕〔10-7〕═10-14
kw称作水的离子积常数,简称水的离子积,它表明在一定温度下,水中H+离子和OH-离子的浓度之间的关系。
水在不同的温度下的离子积常数值是不同,的我们看见表。
在0℃时离子积K(W)=1.3×10-15
25℃时离子积K(W)=1×10-14
100℃时,〔H+〕=〔OH-〕=1×10-6mol/L,离子积K(W)=7.4×10-13
由水分子解离出的H+和OH-数目在任何情况下都是相等的。只是离子积常数随温度升高而增大。
室温时
kw═〔H+〕〔OH-〕═〔10-7〕〔10-7〕═10-14
K(W)=10-14
二、溶液的酸碱性
既然在水中氢离子与氢氧根离子的乘积为一常数,这就是说在水溶液中氢离子与氢氧根离子总是同时存在的。那么酸性和碱性溶液的区别在哪里?我们知道,纯水之所以不显酸性,也不显碱性,而显中性,是由于纯水之中的氢离子浓度与氢氧根离子浓度相等。酸性溶液之所以呈酸性是由于其中氢离子浓度大于氢氧根离子浓度,即〔H+〕>〔OH-〕,这是因为酸性溶液中的氢离子除由水解离而产生的以外,主要是酸分子解离而产生的,因此氢离子溶度大于氢氧根离子溶度。同理在碱性溶液中的氢氧根离子浓度超过氢离子浓度,〔OH-〕>〔H+〕溶液显碱性。所以酸性溶液或碱性溶液的差别,就是溶液的中的氢离子浓度和氢氧根离子浓度的不同而已。
根据水的离子积常数等于10-14,氢离子浓度与氢氧根离子浓度是成反比关系的,氢离子和氢氧根离子中的任何一项的增大,必然引起另一项的减小,所以可根据它们之间存在的这种制约关系,可用氢离子溶度、也可用氢氧根离子溶度中的任何一项来表示溶液的酸碱性,两种表示溶液的酸碱性都是一样的,但习惯上常用氢离子溶度表示。
在常温下,稀溶液中〔H+〕和〔OH-〕的离子积总是10-14,知道〔H+〕就可以计算出〔OH-〕,反之也一样。在室温下,酸碱性与溶液中〔H+〕和〔OH-〕的关系我们可以概括如下:
1.酸性溶液中:〔H+〕>1.0x10-7mol/L、〔H+〕>〔OH-〕,
2.中性溶液中:〔H+〕=〔OH-〕=1.0x10-7mol/L
3.碱性溶液中:〔H+〕<1.0x10-7mol/L〔H+〕<〔OH-〕,
因此,用〔H+〕和〔OH-〕都可以表示溶液的酸碱性强弱。
三、溶液的pH
我们常遇到一些H+浓度很小的水溶液.,如果直接用浓度H+表示溶液的酸碱性,使用和记忆都很不方便。为了简便,我们采用pH来表示溶液的酸碱性。所谓的pH是指氢离子浓度的常用对数的负数。
pH与〔H+〕之间的关系:
即:pH=-lg〔H+〕
根据pH的定义很容易得出,
酸性溶液〔H+〕>1.0x10-7mol/L它的pH<7、
碱性溶液〔H+〕<1.0x10-7mol/L它的pH>7、
中性溶液中:〔H+〕=1.0x10-7mol/L它pH=7
〔H+〕越小pH越大,反之〔H+〕越大pH越小。
溶液中的H+浓度也可以用OH-浓度表示、因此也可用pOH表示,
pOH的定义同pH相似,pOH是指氢氧根离子浓度的常用对数的负数。
pOH=-lg〔OH-〕
〔H+〕〔OH-〕═10-14
-lg〔H+〕-lg〔OH-〕═lg10-14
pH+pOH=14
例1、已知0.1mol.L-HAc的[H+]浓度═1.34×10-3mol.L-求pH多少?
解:pH=-lg〔H+〕═-lg〔1.34×10-3〕═2.87
答:pH为2.87
例2、已知pH=4.35时〔H+〕多少?
解:pH═-lg〔H+〕═4.35
〔H+〕═4.47×10-3mol.L-1
答:〔H+〕═4.47×10-3mol.L-1
例3、已知0.1mol.L-NH3·H2O的pH多少?
(KNH3.H2O═1.8×10-5)
![]()
起始浓度mol.L- 0.1 0 0
平衡浓度mol.L- 0.1-x x x
Kb═〔NH4+〕〔OH-〕/〔NH3〕═x2/(0.1-x)═1.8×10-5
(0.1-x≈0.1) x═1.34×10-3 mol.L-
[OH-]═1.34×10-3 mol.L-
〔H+〕═1×10-14/1.34×10-3═7.5×10-12
pH═-lg〔7.5×10-12〕═11.12
答:pH为11.12
pH的应用范围一般在0-14之间,相对于溶液中的〔H+〕就是在1-10-14mol.L-1之间,当〔H+〕超过1mol.L-1的酸性溶液时pH就小于0,如10mol.L-1HCl溶液的pH= - 1;反之〔H+〕小于10-14mol.L-1,既[OH-]超过1mol.L-1时pH就大于14,如10mol.L-1NaOH溶液pH=15,因此,对于〔H+〕>1mol.L-1的酸性溶液或[OH-]>1mol.L-1的碱性溶液的〔H+〕或[OH-]的表示方法,一般不再用pH了,而直接用物质的量浓度表示。
四、酸碱指示剂
pH是反映酸碱性的一个重要数据,因此,在生产和科学实验中,控制和测定溶液的pH是非常重要的。测定溶液的pH的方法很多,例如用酸度计可以准确测量溶液的pH。但是在实际工作中,有时只需要大概知道溶液的pH是多少,以便及时调节和控制,这时常用酸碱指示剂和pH试纸,所谓的酸碱指示剂是指借助其颜色改变来指示溶液pH的物质。酸碱指示剂都是一些有机弱酸或有机弱碱,在不同的酸碱性溶液中,会显示不同的颜色。由于pH指示剂在不同pH值的溶液中能产生可逆的色泽变化,所以可以在中和分析中,指示反应终点,并可测定被试液的pH值。pH指示剂的质量主要控制在pH变色范围的灵敏度。由于颜色的转变的观察,受主观判断所影响,导致误差。因此需要测定较准确的pH值通常使用pH计测量。
常用酸碱指示剂的变色范围
指示剂名称范围酸色中性色碱色
甲基橙:3.1-4.4红橙黄
甲基红:4.8-6.0红橙黄
溴百里酚蓝:6.0-7.6黄绿蓝
酚酞:8.2-10.0 无色浅红红
紫色石蕊:5.0-8.0红紫蓝
从上表中指示剂的变色范围可以看出,指示剂一般只能粗略地表示溶液的酸碱性,要比较精确地知道溶液的酸碱性,可用pH试纸。
pH试纸按测量精度上可分0.2级、0.1级、0.01级或更高精度。pH试纸上有甲基红、溴甲酚绿、百里酚蓝这三种指示剂。甲基红、溴甲酚绿、百里酚蓝和酚酞一样,在不同pH值的溶液中均会按一定规律变色。
pH试纸使用方法
检验溶液的酸碱度:取一小块试纸在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测液点滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,判断溶液的性质。
检验气体的酸碱度:先用蒸馏水把试纸润湿,粘在玻璃棒的一端,再送到盛有待测气体的容器口附近,观察颜色的变化,判断气体的性质。(试纸不能触及器壁)
pH试纸使用注意:
1、试纸不可直接伸入溶液。
2、试纸不能测浓硫酸的pH。
3、试纸不可接触试管口、瓶口、导管口等。
4、测定溶液的pH时,试纸不可事先用蒸馏水润湿,因为润湿试纸相当于稀释被检验的溶液,这会导致测量不准确。正确的方法是用蘸有待测溶液的玻璃棒点滴在试纸的中部,待试纸变色后,再与标准比色卡比较来确定溶液的pH。
5、取出试纸后,应将盛放试纸的容器盖严,以免被实验室的一些气体污染。
6、必须在常温下使用,否则会导致结果不准确。
小结:
1、kw称作水的离子积常数,简称水的离子积
K(W)只随温度变化而变化,是温度常数。如25℃时
〔H+〕=〔OH-〕=1×10-7mol/L,K(W)=1×10-14
2、溶液的酸碱性
常温下,稀溶液中〔H+〕和〔OH-〕的离子积总是1.0x10-14,知道〔H+〕就可以计算出〔OH-〕。在室温下,酸碱性与溶液中〔OH-〕和〔OH-〕的关系:
(1).酸性溶液中:〔H+〕>〔OH-〕,〔H+〕>1.0x10-7mol/L
(2).中性溶液中:〔H+〕=〔OH-〕=1.0x10-7mol/L
(3).碱性溶液中:〔H+〕<〔OH-〕,〔H+〕<1.0x10-7mol/L


