弱电解质的解离平衡
在一定条件下(如温度,压强),当弱电解质分子解离成离子的速率与离子重新结合成分子的速率相等时,解离的过程就达到了平衡,即解离平衡。这时的平衡是动态平衡,也就是说弱电解质分子解离、以及离子重新结合成分子都在不断的进行,只是溶液中的各种离子的浓度以及分子的浓度是不随时间改变。
弱电解质在一定条件下解离达到平衡时,解离的离子浓度乘积和未解离的分子浓度比值,是一个常数,这个常数叫做该弱电解质的解离平衡常数,简称解离常数。解离常数和平衡常数一样,与温度有关而与浓度无关。
下面我们用醋酸的实例进一步来说明解离过程,根据化学平衡原理,醋酸溶液在解离平衡时未解离的醋酸分子和已解离的氢离子的离子、醋酸根离子之间的浓度关系如下:
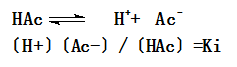
式中Ki叫解离平衡常数。
一般用Ka表示弱酸的解离平衡常数,用Kb表示弱酸碱的解离平衡常数如:
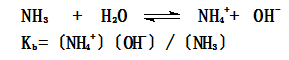
解离平衡常数的大小反映弱电解质的解离为离子的多少有关,解离平衡常数(Ki)值越大,弱电解质的解离程度越大,离子数目越多。所以解离平衡常数也是表示弱电解质相对强弱的一个常数。
例如在室温下醋酸的解离平衡常数KHAC=是1.8×10-5、氢氰酸的解离平衡常数KHNC=是6.2×10-10显然氢氰酸解离平衡常数比醋酸的小,所以氢氰酸的酸性比醋酸的酸性弱。
解离平衡常数我们可以在化学手册中查找。
不同温度时有不同的解离常数。解离平衡常数同化学平衡常数一样,与温度有关,而与浓度无关,由于温度对它的影响不像化学平衡常数那样大,所以在室温范围内,温度对影化学平衡常影响可忽略。
解离度和解离平衡常数,都能表示弱电解质之间的相对强弱;但是二者既有区别又有联系。解离平衡常数是化学平衡常数的特例,因为它与浓度无关而与温度有关:解离度是转化率的一种特例,它随浓度的增加而降低。二者之间有一定的定量关系。
现以HAC弱酸为例来说明解离度α与Ki解离平衡常数的关系,设醋酸的原始浓度为cmol.L-1解离度为α

当离平衡常数(Ki)值很小时,解离度(a)很小时,1-a≈1
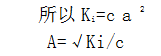
这个公式说明解离度a与该电解质的解离常数Ki值的平方根成正比,与溶液浓度的平方根成反比。所以也称这种关系叫稀释定律。


上述公式,只适用对解离度和解离平衡常数值较小的弱电解质的近似计算,一般以C/Ki≥500作为近似计算的条件,否则应精确计算。
以上我们讨论的醋酸的解离,醋酸是属于一元弱酸,那么多元弱酸是怎样进行解离的呢?实验证明多元弱酸的解离是分步进行的,多元弱酸中的氢离子是依次一个一个的解离成氢离子的,但是决定溶液中H+浓度的主要是第一步解离;决定酸根离子浓度的主要是最后一步解离。
所谓的多元酸是指该酸的1个分子可以解离出2个或2个以上的H+离子,可以解离出2个的H+离子是二元酸例如H2S;可以解离出3个的H+离子是三元酸,例如H3PO4。
多元弱酸分步解离,解离方程式必须分步书写。

因此,可以用溶液中的氢离子浓度,控制溶液中的硫离子浓度。这一关系在分析化学在得到广泛应用。
多元弱碱虽是分步解离,但书写解离方程式可按一步解离写出。


