 溶液浓度对化学反应结果的影响
溶液浓度对化学反应结果的影响
实验用品:
试管(具双孔胶塞 )、分液漏斗、弯曲玻璃导管、铁架台、铁夹、胶管、量筒、水槽、托盘天平、药匙、秒表、二氧化锰、过氧化氢溶液(6%、5%、4%、3%、2%)。
●  取一只配有双孔胶塞的试管,胶塞的一孔中插入分液漏斗,另一端插入弯曲的玻璃导管,然后将试管垂直固定于铁架台上。 (如右图)
取一只配有双孔胶塞的试管,胶塞的一孔中插入分液漏斗,另一端插入弯曲的玻璃导管,然后将试管垂直固定于铁架台上。 (如右图)
● 称取约0.1克二氧化锰放入试管,塞进胶塞,向分液漏斗中注入5毫升6%的过氧化氢溶液,打开分液漏斗上的旋塞,使过氧化氢溶液进入试管,立即会观察到有气体产生,反应生成的气体通过导管进入一只盛满水倒立于水槽中的50毫升量筒中,记录在2.5分钟内量筒里所收集到的气体体积。
● 分别用5%、4%、3%、2%的过氧化氢溶液代替6%的过氧化氢溶液,重复上述操作,记录在2.5分钟内量筒里所收集到的气体体积。
● 用过氧化氢溶液的百分比浓度作横坐标,以收集到的气体体积作纵坐标,连接图中各点,则得到一条随着过氧化氢溶液浓度的减小,在相同时间内反应生成气体的体积(即反应速度)减小的曲线。
过氧化氢在二氧化锰的催化下,可分解为水和氧气。其在其他条件相同的情况下,过氧化氢的分解速度和溶液的浓度有关。实验表明,在2.5分钟内,收集的氧气体积是各不相同的,而且过氧化氢的溶液浓度越高,收集的氧气体积就越大,即反应速度越快。
 兴趣实验-振荡反应
兴趣实验-振荡反应
化学家自19世纪以后陆续发现,有一些化学反应中的某些组分或中间产物的浓度能够随时间发生有序的周期性变化,即所谓化学振荡现象。
在化学振荡反应发现的初期,人们感到难以理解。他们认为这种魔术一般的“古怪行为”是在跟热力学第二定律开玩笑。这正像一个大城市的千百万居民都能在同一时间做同一个体操动作一样,令人不可思议。
在振荡反应中分子及离子的无序碰撞怎么会自发地走向有序?自20世纪60年代以来人们提出了自催化振荡,产物活化,环境温度起伏和反应序列存在反馈等理论模型试图解释,然而均未能全面和深入地揭示出自组织过程的本质,直到耗散结构理论的提出,才得以圆满解决原理。
❤ 实验现象:溶液颜色在蓝色,琥珀色,无色三者间反复变化(约可呈现二十多个周期)
❤ 所需药品:双氧水,丙二酸,碘酸钾,硫酸,硫酸锰,淀粉,蒸馏水
❤ 实验要求:称量要准确,溶液温度20-35度为宜。
❤ 配制下列三种溶液
♠ A液:102.5 ml 30% H2O2 用水稀至250 ml
♠ B液:10.7g KIO3 ,10ml 2mol/L H2SO4 用水稀至250 ml
♠ C液:3.9g丙二酸CH2(COOH)2 ,0.845gMnSO4,0.075g淀粉,用水稀至250ml(淀粉用少量水先溶解,再至沸)演示时将A,B,C液各50ml混合即可。
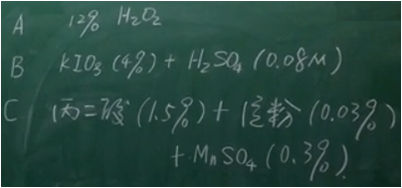
❤ 配制三种溶液 A液:12% H2O2 B液:4% KIO3 ,0.8M H2SO4 C液: 1.5%丙二酸CH2(COOH)2 ,0.3%MnSO4,0.03%淀粉
❤ 实验现象:溶液颜色在蓝色,琥珀色,无色三者间反复变化(约可呈现二十多个周期)。

![]()


