 化学实验研究的因素分析思想
化学实验研究的因素分析思想
因素也称因子,是试验中考查对试验指标可能有影响的实验条件,它是试验当中重点要考查的内容。
因素除了可分为探究因素和非探究因素之外,又分为可控因素和不可控因素。在现有科学技术条件下,能人为控制和调节的因素称为可控因素;反之为不可控因素。
试验中,一般选择可控因素作为探究因素,但也并非每种可控因素都要作为探究因素,而是根据其对指标的影响程度来选择;不可控因素均作为非探究因素,试验时要尽量保持其一致。
 氯酸钾制取氧气实验的探究
氯酸钾制取氧气实验的探究
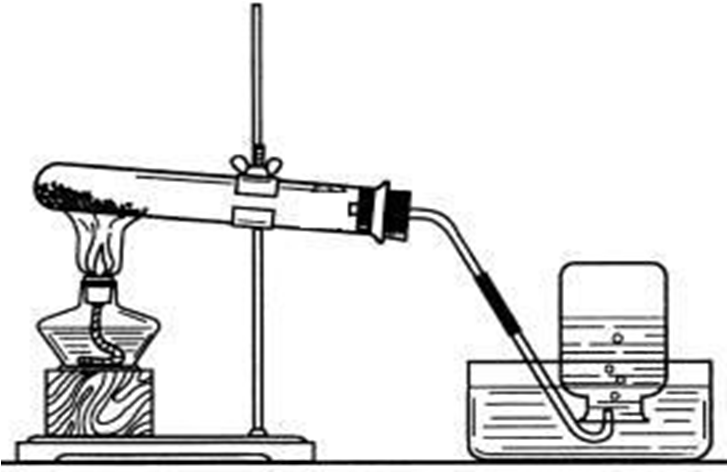

❤ KClO3与MnO2的质量配比的探究 ❤
可选择1:1、2:1、3:1、5:1、10:1、20:1等(也可自己选择,但各点分布应科学合理)。其中每次试验中的KClO3的质量应固定不变。中学化学教参把该演示实验KClO3与MnO2的用量定为5g:1.6g (约3:1,供参考)。

❤ 氯酸钾制氧气反应中催化剂的探究 ❤

在比较不同催化剂效果时,其他的反应条件应保持一致。
例如,选用的试管大小要相同、加热灯具及火焰温度要一致、混合的程度及颗粒大小也要相近等等。
实验说明
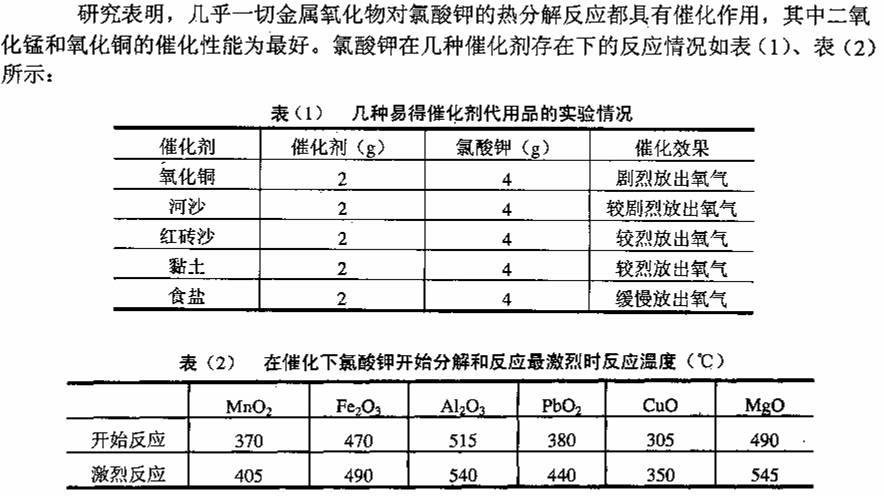
本实验可用多种物质来作催化剂,氧化铜仅是其中一。
在比较不同催化剂效果时,其他的反应条件应保持一致,另外,不同催化剂对同一个反应作催化时,它们各自在达到最佳效果时的用量比例不一定相同。
所谓的实验效果应是多方面的,例如产气的速度,产气的量,有否产生白烟、火星,有否较多的副反应等。

❤ 氯酸钾制氧气的产气速率探究 ❤
实验效果主要是指产生氧气的快、慢,产氧的速度是否均匀及产气的总量有否变化等。
当用KClO3制取氧气,用MnO2作催化剂时,也可通过多次对比实验对氧气的产气速率进行研究。 有人取KClO3粉末4克,MnO2的量分别为KClO3的1/2、1/3、1/10、1/20倍等。收集氧气的量为一升左右。从生成氧开始,每隔10秒钟测一次氧的生成量,将两者数据画成坐标图。
 反应物与催化剂质量配比对产气速率影响
反应物与催化剂质量配比对产气速率影响
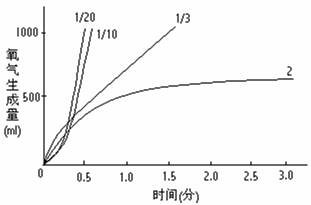 MnO2的量少时,催化剂接触面积太小,不到高温则难生成氧气。但一旦开始就会急剧反应,生成速度很不均匀。
MnO2的量少时,催化剂接触面积太小,不到高温则难生成氧气。但一旦开始就会急剧反应,生成速度很不均匀。
如采用1/10,实验开始来不及收集,显然是不适宜的。如果MnO2过多,则虽然氧气较早产生,且速度也较均匀,但收气时间过长,也不理想。
MnO2的量为1/3左右时,产生氧气也较早,并且速度适中而均匀,适宜于在课堂上安全从容地进行收集。
 木炭还原氧化铜实验研究
木炭还原氧化铜实验研究
影响固相化学反应实验效果的主要因素:
❤ 反应物颗粒的大小
❤ 实验时加热的温度

❤ 试管的大小(装置对实验的影响)


