乙酸乙酯的制取
教学内容
通过酯化反应制备约10ml乙酸乙酯粗品
纯化所制得的乙酸乙酯
设计实验课教案,指导学生成功进行相关实验
基本概念
在少量酸(H2SO4或HCl)催化下,羧酸和醇反应生成酯,这个反应叫做酯化反应(Esterification)。该反应为可逆反应,为了完成反应一般采用大量过量的反应试剂(根据反应物的价格,过量酸或过量醇)。有时可以加入与水恒沸的物质不断从反应体系中带出水移动平衡(即减小产物的浓度)。
乙酸乙酯是一种有机酸酯,它是以浓硫酸作催化剂的条件下,由乙酸与乙醇发生酯化反应:

酯化反应为可逆反应,为提供产率,根据化学平衡原理,可采取以下措施:一方面加入过量的乙醇,另一方面在反应过程中不断蒸出生成的产物和水,促进平衡向生成酯的方向移动。
标准操作
分液操作
分液是把两种不相混溶的液体进行分离的操作方法,所使用的仪器是分液漏斗。
其操作方法如下:
(1)先将分液漏斗颈上的旋塞芯取出,涂上适量的凡士林,插入塞槽内转动使油膜均匀透明,且转动自如。
(2)检查是否漏水。关闭分液漏斗的活塞,加入适量的水,将分液漏斗放在铁圈上;在下面接一个烧杯,打开上口塞或使塞上的凹槽(或小孔)对准漏斗口上的小孔,使分液漏斗内气体与大气想通,看活塞处和颈部是否有水漏出,若不漏,将活塞旋转180度,不漏水,则活塞的密封性能合格。关闭上口塞,倒置分液漏斗打开活塞,若是不漏,正置分液漏斗,将上口塞旋转180度,再次倒置,打开活塞,若还是不漏,则分液漏斗上口塞的密封性能合格。
(3)使用加入液体,并使装入液体的总体积不要超过分液漏斗容积的2/3;充分振荡液体,具体手势为,先用右手食指的末节将漏斗上端玻璃塞顶住,再用大拇指及食指和中指握住漏斗,这样漏斗转动时可用左手的食指和中指蜷握在活塞的柄上,使振荡过程中玻璃塞和活塞均加紧。上下振摇分液漏斗,每隔几秒钟将漏斗倒置(活塞朝上)小心打开活塞,以平衡内外压力,重复操作2~3次。
(4)放出下层液体时,分液漏斗劲的尖端要紧靠在盛接液体的容器的内壁,以免液体迸溅;旋转分液漏斗活塞上的活拴时,要使活拴指向手心,以防活拴脱出漏出液体;当下层液体恰好流尽时,要立即关闭活塞,以免上层液体流出。上层液体要从分液漏斗的上口倒出,防止两种液体再度混合。
(5)分液漏斗用后洗涤干净,不用的分液漏斗要把旋塞处擦拭干净,并在上口与塞子之间、塞芯与塞槽之间放一纸条,以防磨砂处粘连。
实验步骤
蒸馏法
(1)按图连接装置,检查装置的气密性。
(2)在大试管中加入6ml乙醇和4ml冰醋酸,再缓缓的加入4ml浓硫和碎瓷片,振荡使其混合均匀。
(3)开始用小火加热混合液,后逐步提高加热温度,不可使溶液沸腾,或用水浴加热,保持温度在60~70℃,产生的蒸汽经导管通到饱和Na2CO3溶液的液面上。数分钟后,在饱和Na2CO3溶液的液面上看到有透明油状物生成,并可以闻到一种特殊的香味,这就是生成的乙酸乙酯。待导管右端不再产生无色液体即反应完毕后,用分液漏斗分出有机层,即为乙酸乙酯。
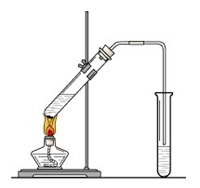
回流法
(1)按图连接装置,检查装置的气密性。
(2)在大试管中加入6ml乙醇和4ml冰醋酸,再缓缓的加入4ml浓硫和碎瓷片,振荡使其混合均匀。
(3)试管用单孔塞配一根竖直的长玻璃导管作为冷凝管(不宜过短,以30cm左右为宜),做成一个冷凝回流的装置。把试管放在沸水里加热3~5min,然后从沸水中取出冷却(或放在冰水中冷却)。
(4)向混合液中加入4ml水,震荡后,静置片刻,可以看到水和酯的界面,然后将酯的部分转移至盛有饱和Na2CO3的溶液的分液漏斗中进行分离,即为乙酸乙酯。

内容拓展
洗涤粗产物
(1)中和:在粗乙酸乙酯中慢慢地加入约10mL饱和Na2CO3溶液,直到无二氧化碳气体逸出后,再多加1~3滴。然后将混合液倒入分液漏斗中,静置分层后,放出下层的水。
(2)水洗:用约10mL饱和食盐水洗涤酯层,充分振摇,静置分层后,分出水层。
(3)二氯化钙饱和溶液洗:再用约20mL饱和CaCl2溶液分两次洗涤酯层,静置后分去水层。
(4)干燥:酯层由漏斗上口倒入一个50ml干燥的锥形瓶中,并放入2g无水MgSO4干燥,配上塞子,然后充分振摇至液体澄清。
(5)精馏:收集74~79℃的馏份,产量约10~12g。



