水的电解
教学内容
电解法证明水中含有氢元素和氧元素
电解产生氢气和氧气,比例约是2∶1
设计一个教案,说明水的组成是H2O
基本概念
电解质溶液的电解原理是在直流电的作用下,溶液中的离子发生定向移动,即阳离子向阴极放些移动,阴离子向阳极方向移动。
当水电解时,两极的反应分别是:
阳极: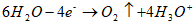 (氧化)
(氧化)
阴极: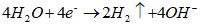 (还原)
(还原)
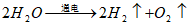
当电火花通过氢、氧混合气体时,它们即生成水。
实验步骤
(1)按照装置图,连接霍夫曼电解器,在测气管的活塞薄薄的涂上一层凡士林,检查装置的气密性,打开测气管的活塞,从漏斗中加入一定量的水,记下测气管的液面位置,关上测气管的活塞,继续加一些水,静置几分钟,观察液面位置有无变化,如果没有变化,则说明电解器气密性良好,然后打开电解器下口塞将水排出。

(2)配制一定浓度的稀酸,装上电极,打开测气管的活塞,将配制好的稀酸装入电解器中,装上在电解器中不能留有气泡,关闭测气管的活塞。
(3)两个电极通过导线与电源的正、负极相连,打开电源,调整到一定电压,进行电解。
(4)通电电解一段时间后,停止通电,测得产生气体的体积,准确的得到两极产生的气体体积关系,并验证所产生的气体为何。
(5)H2检验:点燃尖嘴处,观察到淡蓝色的火焰。
O2检验:将带火星的木条靠近尖嘴处,发现木条复燃。
(6)实验结束后,将酸液排出,并将电极、电解器洗干净放好。
备注:探究不同仪器装置、不同溶液种类、不同溶液浓度、不同电极、不同电压、不同电解时间等影响因素对水的电解实验的影响。
内容拓展
1、电解水时生成氢气与氧气体积比的误差分析。
从水分子的结构可以得知,电解水生成的V(H2):V(O2)=2:1但在实验时无论如何操作,电解生成的H2和O2的体积比都不是理论值2:1,而是略大于2:1。这种误差产生的原因主要是:
(1)H2和O2在水中的溶解度不同
通过实验测定,在20℃、101kPa下,H2的溶解度为0.0182g/100g水,而O2的溶解度为0.031g/100g水,所以电解生成的氧气较多的溶解于水,这样电解产生的V(H2):V(O2)>2:1。
(2)与电解液的种类有关
如果用稀硫酸作电解液,可能发生下列副反应:
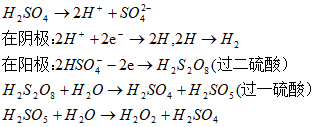
生成的过氧化氢在酸性溶液中较稳定,不易分解放出氧气,这也使得电解所产生的V(H2):V(O2)>2:1。
(3)阳极材料被氧化要消耗一部分氧气
氧气是一种强氧化剂,在电解过程中氧气往往要氧化阳极材料而被消耗掉一部分。
(4)阴、阳两极的电流效率可能不同
在电解水实验时,特别是使用简易装置,即使用惰性电极也有一些铝或铜质导线不同程度上的浸没在电解液中,根据电化学原理,我们知道在阴极无论是使用惰性电极还是活泼电极,电极均不参与电解反应,只有H+被还原成H2,而在阳极情况就不同了,只有阳极为惰性电极时,电极材料才不参加电解反应,如果有部分连接导线(往往为铜质与铝质)浸没在电解液中,导线就会部分溶解而消耗掉一定电量,这样产生O2的量就会减少。
2、电解水时为什么要加入少量电解质
通过纯水的导电实验测得,在25℃时,纯水中H+和OH-的浓度等于10-7mol·L-1。因此,实际上观察不到水的电解现象。这是因为,当H+在阴极上得到电子而生成氢气时,破坏了附近水的电离平衡,最终使阴极附近的OH-的数目相对增多,这就使阴极附近的溶液带负电,它会吸引其他的H+并阻止H+继续在阴极上放电。阳极的情况与此相仿。若在水中加入少量某种强电解质,由于这些强电解质在溶液中全部电离,离子数目增多,在电场的影响下分别向两极移动。这样,水在电解时,阴阳两极附近的溶液里离子的电荷得到平衡,使水的电解能继续进行。
3、水电解器的电极材料和电解液的选择
用不同的电极材料,进行电解水实验,铂电极最好,但价格较高。在自制水电解器时,多采用其它材料做电极,但需要注意的是要注意电极材料与电解液的匹配,其基本原则是,所选的电极材料应不与所用的电解液起化学反应,而且在电解时能在电极表面形成不溶于该电解液的保护膜。
实验证明,用5%~10%的氢氧化钠溶液做电解液时,用铁钉等做电极较好。若果用10%稀硫酸作电解液,保险丝、不锈钢丝或镀铬曲别针等是较好的电极材料。
4、电解液浓度、电极距离和电压的选择
若电解液的酸或碱浓度过低,电解速度太慢,时间太长,不符合演示实验要求;若酸或碱浓度过高,腐蚀性大,操作不安全。经验证,酸或碱电解液的浓度一般选择在5%~10%为宜。
当电极材料和电极面积相同且电解液的浓度一定时,电压高、电极距离近则电解速度快。相反的,电压低、电极距离太远,电解速度慢。一般我们选择10~20V之间的低压直流稳压电源的电压。


