氢气的制取和性质
教学内容
设计具有简易启普发生器
用简易启普发生器制取氢气
氢气性质的实验:可燃性;爆鸣实验;还原氧化铜;吹氢气泡
基本概念
氢气的制取
实验室制取氢气常用方法:金属锌跟稀酸反应制得氢气
Zn+ 2HCl → ZnCl2 + H2↑
Zn+ H2SO4→ Zn SO4 + H2↑
氢气的性质
无色无味,密度比空气小,难溶于水。
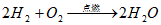
燃烧火焰为淡蓝色,与空气按4%~74.2%混合,燃烧爆炸。

标准操作
启普发生器一种实验室常用的气体发生装置,是荷兰科学家启普(PetrusJacobus Kipp 1808~1864)发明,并以他的姓命名。它用普通玻璃制成,构造见图。它由球形漏斗、容器和导气管三部分组成。适用于块状固体与液体在常温下反应制取气体,如氢气、二氧化碳和硫化氢等。
启普发生器的安装和使用
安装 将球形漏斗和容器颈部磨砂以及导气管活塞擦拭干净,薄薄的涂上一层凡士林,安装好,旋转达到均匀透明。
检查气密性 旋开导气管活塞,加水至充满半球体,关闭活塞,继续加水至液面达漏斗球体容积的一半处为止,作一记号。静置5min入水面不下降,即证明启普发生器不漏气。
排酸\n \n启普发生器用完后要排出废酸,先用水代替酸来进行排酸练习。先关闭导管活塞,用橡皮塞塞在球形漏斗口,然后右手握住启普发生器容器的球体,稍倾斜使半球的下口朝上,置于大口接收器之上,左手拔去半球体下口的塞子,让酸缓缓流出。这个操作要反复练习,做到酸不流到接收器外,手不沾上酸。
加锌 拔去插导气管的橡皮塞,将锌粒从此口加入,其量不得超过球体容积的1/3,注意不要让锌粒漏到半球体中。为此,可在球体与半球体之间加一带小孔的橡皮圈或放些玻璃棉。
加酸 打开导气管活塞,将酸从球形漏斗加入,至刚好浸没锌粒为止,关闭活塞,待用。
实验结束后,放出废酸,取出锌粒用水洗净,晾干备用。把启普发生器冲洗干净,将导气管活塞和容器与球形漏斗以及下口玻璃塞的磨砂处擦干净,垫上纸条,以防黏连。
中途加锌的方法:将酸液压到球形漏斗中,用橡皮塞塞住漏斗口,拔去插导气管的橡皮塞,从开口处加锌。
中途换酸的方法:加酸的浓度太稀,需中途换上一部分浓酸,则按操作(3)排掉一部分稀酸,从漏斗加入一部分浓酸。
固-液反应(不加热)气体发生装置
固液相反应装置的选择,可由气体制取体积、是否需要控制反应速率等进行选择。固体药品颗粒的大小也是装置选择时一个重要因素。
实验步骤
氢气的制取
按照设计的简易启普发生器,连接好装置,并检查装置的气密性。
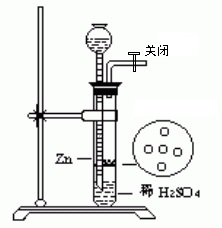
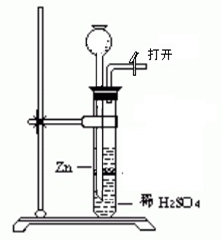
向试管内装入数粒锌粒,然后用橡皮塞塞紧试管口。
打开导管活塞,向长颈漏斗中加入稀硫酸,至刚好浸没锌粒为止。关闭活塞,待用。
进行性质实验前,对制得的氢气进行验纯。
验纯方法为:打开导管活塞,用向下排空气法收集一小试管氢气,管口向下移进酒精灯火焰,若听到尖锐的爆鸣声,就表示氢气不纯,需再收集进行验纯。此时应更换一支试管,直至验纯时发出“噗”声为止,此时氢气已经较纯,可以进行性质实验。
氢气的性质
用氢气吹肥皂泡,证明氢气比空气轻。
用玻璃导管或橡胶管接在氢气发生器上,蘸取肥皂液吹泡,慢慢打开制取氢气开关,待气泡出现后,将管口迅速反转朝上,轻轻摆动或吹起,肥皂泡迅速脱离管口上升,用火在气泡上方点燃,随着轻微“噗”的一声,伴有黄色火球出现。
氢气与空气混合爆炸。
取一支顶端开口的易拉罐瓶,在其底部凿一火柴梗粗细的小孔,先用胶带将其底部的小孔堵住,然后用向下排空气阀收集少量氢气,找一个带有与该瓶子开口一样大小塞子的电子打火枪,然后走到空旷的地方,打枪,会听到“砰”的一声爆鸣声。
氢气在空气中的燃烧。
在导管上连接一尖嘴玻璃管,将已经验纯的氢气点燃,观察到淡蓝色火焰。接着在火焰上方罩一干净烧杯,可观察到烧杯壁上有小水珠生成。
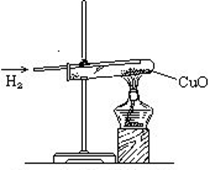
氢气还原氧化铜。
取一干燥的硬质试管,试管底部铺一层薄薄的氧化铜,安装于铁架台上(管口略低于底部),先通一会已验纯的氢气,然后在试管底部加热,当管口有液滴出现时,氧化铜加热部位由黑变为红热,再慢慢变为紫红色。撤掉酒精灯,继续通氢气至试管冷却。
内容拓展
实验室制备氢气为什么不用铁或纯度较高的锌◦
实验室里制备少量氢气的最简单方法就是使用活泼金属和稀硫酸作用,常用金属锌粒而不是廉价的铁。这是由于铁中所含有的含碳化合物在制取氢气时,会生成含碳化合物的气体,混合在氢气中产生难闻的气味。不纯的锌中常含有少量的碳、硅、硫、锑和砷等杂质,它们反应时形成氢化物,混合氢气中,故使得氢气中总有一种特殊气味。
锌粒与稀硫酸反应时,采用何种方法加快反应速度◦
若锌和酸的纯度都比较高时,置换反应进行较慢,不易观察到实验现象。因为进入溶液中的Zn2+受到锌表面过剩负电荷的吸引,在锌周围形成一层带正电荷的离子层,使H+不易接触锌,取得电子而放电,使反应不能迅速进行。若锌中含有比锌不活泼的杂质,则在稀酸中形成局部电池,将电子转移到杂质电极上,使H+放电而释放出氢气,反应迅速进行。若使用的锌粒的纯度较高,反应较慢,可在酸溶液中加入少量硫酸铜溶液或放入少量铜屑,使溶液中形成多个微原电池,反应加快。
制取氢气时,锌粒表面的黑色物质是什么◦
将锌粒和稀硫酸反应制取氢气时,经常发现残余的锌粒表面附着一层黑色的物质,或者在锌粒全部溶解后看到有黑色的悬浮物残留在液体中。这是由于不纯的锌粒中常含有Pb、Bi、Cu、Sn等杂质,当锌粒和酸发生反应时,锌中所含有的不活泼金属杂质就游离出来,成微粒状态而呈黑色,并部分沉积在锌粒表面。它们可以形成无数微小的原电池,对氢气发生的速度起促进作用。另外也有一种说法,在锌表面的黑色可能是由于锌原子溶解使表面形成细小的金属颗粒而使其显黑色。
氢气还原氧化铜的实验改进方法◦
这个实验过程中,为了能看到有明显的铜镜生成,可以在装入氧化铜前,在试管底部稍稍湿润下,这样再装入氧化铜就可以保证它均匀地附在试管壁上,加热后就可以看到有明显的铜镜生成。或者选取一段铜丝,用砂纸打磨表面后,先在酒精灯上加热,观察到铜丝表面变黑生成氧化铜后,将此表面附着着氧化铜的铜丝通入氢气还原后,可观察到其表面的氧化铜又变成光亮的铜。
如何配制“特大肥皂泡水”?
十二醇硫酸钠是合成洗涤剂材料,常用来作发泡剂。聚乙烯醇也是一种发泡剂,它是一种高分子聚合物。两者配成水溶液后的表面张力都比较小,两种发泡剂混合后的发泡能力虽有较大的增强,但仍不够理想。利用氯化铵具有的增稠作用,将发泡剂调节到理想的粘稠程度,并具有一定的张力。具体实验步骤为:
称取3g聚乙烯醇(相对分子质量8000-10000)放入250ml烧杯中,加入180ml水,加热搅拌至完全溶解,再冷却至常温。
称取20g十二醇硫酸钠放入500ml烧杯中,加入200ml水,加热到近沸腾,再加入8g氯化铵,搅拌均匀。将聚乙烯醇溶液加入到十二醇硫酸钠和氯化铵的混合液中,搅拌均匀即成高效发泡剂,装瓶备用,即做好了特大肥皂泡水。
\t\t\t\t\t\t\t\t \t\t\t\t \n\t\t\t\t\t\t\n\t\t\t\t\t\t \t\t\t\t \n \t\t\t \n\n


