氧气的制取和性质
教学内容
以氯酸钾为基本原料制得并收集4集气瓶氧气
氧气化学性质实验:跟硫粉反应;跟细铁丝反应;使余烬木条复燃
基本概念
氧气的制取
氯酸钾分解:氯酸钾在400℃分解产生氧气,如果用二氧化锰催化,分解温度大约降低到200℃。
![]()
高锰酸钾分解:
![]()
双氧水催化分解:
![]()
氧气化学性质
硫、在空气中点燃,在氧气中燃烧更剧;
S + O2→ SO2(点燃)
铁丝在空气中不能燃烧,在氧气中可以点燃
3Fe+2O2→ Fe3O4(点燃)
使余烬木条复燃,是检验氧气的实验室检验氧气的方法。
标准操作
实验仪器的装配
在化学实验中,正确的实验操作能保证实验的顺利进行,取得良好的实验效果,还可以防止损坏仪器和发生伤害事故。
把玻璃管插入有孔塞子的方法
一手拿有孔塞子,另一手捏住玻璃管靠近插入塞孔的一端,用水润湿玻璃管口后,边转动边小心地把玻璃管插入塞中。弯曲玻璃管(包括直角),不可捏住玻璃导管的弯曲处,否则旋转时容易折断。
长颈漏斗或分液漏斗和直角玻璃管插入双孔塞的操作跟玻璃管的插入操作相同。装配时要注意,先装配的部分不能妨碍后面仪器或零件的装配。气体出口导管插入时应跟塞子小头相平。
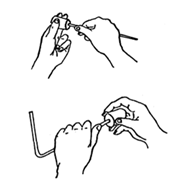
把塞子塞入烧瓶口、试管口的方法
一手拿住烧瓶或试管,另一手拿塞子,边转动边将塞子塞入。塞子塞入的深度是赛高的2/3。不能把容器放在桌上,用力压橡皮塞,这样极易压碎容器。
璃管跟橡皮管的连接
一手拿橡皮管,另一手拿玻璃管,插入的管口用水润湿,在边插边转动时把玻璃管插入橡皮管中。插入的深度是1~1.5cm。
玻璃管插入塞孔玻璃套管上橡皮管用橡皮塞塞住试管橡皮管、塞子、玻璃导管等的连接,关键掌握两个字—润、转。
实验装置的组装和连接
实验仪器的组装,一般按照从低到高,从左到右的顺序进行。
组装仪器的一般规律可概括为:发生装置→气体净化→气体干燥→收集装置→尾气处理。须强调的是:仪器的组装顺序(包括实验操作顺序)因实验而异,并没有固定、统一的模式,上面所提及的仅为一般定律。实验中,若涉及仪器的组装顺序(包括各接口顺序)时,要根据具体情况进行选择。其中各分装置的接口顺序如下:
溶液洗气装置(包括用浓硫酸除杂、干燥)“长进短出”。
排水集气装置“短进长出”。
干燥管“大进小出”。
在实验装置的拆卸过程,则与组装过程相反,拆卸加热装置、并有导管伸入到液体中时,应先将导管取出液面,再停止加热,以防倒吸。
装置气密性检测
气密性检查原理为:压强原理
给装置内的空气预设一条通路并将其通入水中,使装置内密封的空气的压强增大,体积膨胀,空气就会沿着预设的通路逸出。
向装置内注入液体达到一定的高度,将原先装置内的空气密封在内,由于液体高度的原因而增压,若气密性良好,液体就不会下降。
检查方法:
微热法:将A中导管b的下端浸入水中,用手捂住烧瓶(如果装置复杂,可用酒精灯加热)导管口有气泡冒出,松开手(或撤离酒精灯)后,导管b内形成一端水柱,则气密性良好。对于下列B装置要先向左边试管中加水封闭长颈漏斗的下端后再检查;对于C装置要先向安全漏斗里加水封闭漏斗颈后再检查。
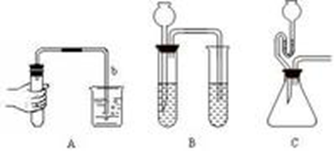
液差法:启普发生器A:先关闭导管,向球形漏斗中加水,使漏斗中的液面高于容器的液面,静置片刻液面不变,则气密性良好。装置B:先夹紧弹簧夹,从漏斗注入一定量水,使漏斗内水面高于试管内的水面,静置后液面不变,则气密性良好。装置C:先夹紧弹簧夹,从漏斗注入一定量水,打开分液漏斗活塞,水流下的速度越来越慢,直至不再滴下,则气密性良好。装置D:向乙中注入适量水,使乙管液面高于甲管液面,静置后液面不变,则气密性良好。装置E:在烧杯中注入适量水,打开止水夹,水进入干燥管后关闭止水夹,升高干燥管,如果干燥管内液面高于烧杯中液面,则气密性良好。对于E装置也可用以下方法检查气密性:关闭止水夹,将干燥管插入水中,片刻后如果烧杯中的液面高于管内液面,则气密性良好。
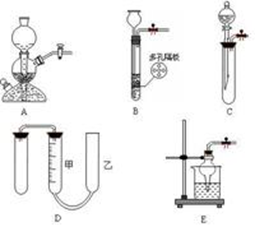
气体的收集装置
收集气体时,可根据气体的水溶性和对空气的相对密度而选择排水法或排空气法收集。
排水法:装置如图所示。若气体难溶于水且不可与水反应,则可用排水法收集(如:H2、O2、NO、CO等);若气体可溶于水但溶解度不大或与水能缓慢反应,则可用排饱和溶液法收集(如CO2可用排饱和NaHCO3溶液法收集,SO2可用排饱和NaHSO3溶液法收集,H2S可用排饱和NaHS溶液法收集,Cl2可用排饱和食盐水法收集等)。

排空气法:装置如图所示。凡在空气中能稳定存在且密度与空气相差较大的气体,可选用排空气法收集。若气体密度大于空气的密度,则用向上排空气法,例如O2、Cl2、HCl、CO2、SO2、NO2、H2S等;若气体密度小于空气的密度,则用向下排空气法,例如:H2、NH3、CH4等。排空气法收集到的气体一般不纯。
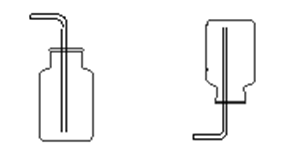
向上排空气法 向下排空气法
实验步骤
氧气的制取
连接好装置,并检查装置的气密性。
将氯酸钾与二氧化锰粉末的粉末混匀,装入试管底部,并用食指轻弹,使反应物自然铺开成斜坡状。(理论计算收集适量氧气所需试剂的量)
将集气瓶准备妥当后,点燃酒精灯,进行预热试管,然后对准有药品的部位进行加热。
待气泡连续均匀放出时,用排水法收集氧气,停止加热前,应把气体导管先撤出水槽,后灭灯,否则,反应容器内产生负压,水倒流炸裂试管。
氧气化学性质
线香在氧气里燃烧
取一根线香,在酒精灯上加热至红热,立即伸入成有氧气的集气瓶中,线香在集气瓶中由上至下缓慢移动。
硫在氧气里燃烧
在燃烧匙内放少量细沙,细沙上放少量硫粉,在酒精灯上加热至燃烧,立即伸入盛有氧气的集气瓶中,待实验完毕后,若仍有燃烧着的硫粉,可把燃烧匙浸入碱液中来熄灭。
铁丝在氧气里燃烧
取一根细铁丝,在玻璃棒上绕成小螺旋状,一端系一段火柴杆,作为引燃物。把铁丝在伸进氧气瓶前先在酒精灯上点燃火柴杆,预热铁丝,当火柴杆快燃尽而仍有小火焰时,迅速伸进留有水的集气瓶中,用玻璃片覆盖瓶口半边,并将燃着的铁丝逐渐下移。
内容拓展
1、二氧化锰对氯酸钾分解反应的催化机理
在氯酸钾的分解反应里,对二氧化锰的催化机理,通常有两种观点:一种认为制得的氧气中有氯气的气味,反应先是生成了高锰酸钾:
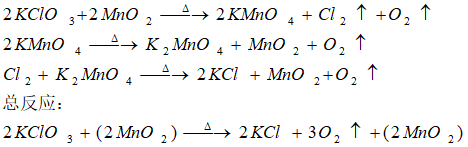
另一种认为中间产物是七氧化二锰,其反应是:
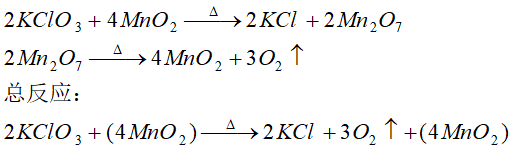
2、氯酸钾制取氧气实验中催化剂的选择
氯酸钾制备氧气实验中,常见的催化剂除MnO2外,还有一些金属氧化物,如CuO、MgO、Fe2O3、Cr2O3,甚至香烟灰渣、粘土等具有催化作用。氯酸钾的差热曲线研究表明:氯酸钾在约360℃时熔化,表现为吸收峰;继续加热,在约500℃出现第一个放热峰;在约580℃出现第二个放热峰,最后,加热至约770℃,出现氯化钾熔化的吸热峰。从差热曲线上看,MnO2的存在使第一、第二放热峰达到了不可分辨的程度,只表现出一个放热峰。而香烟灰渣、粘土等所以具有催化作用,这是由于它们含有多种金属氧化物(包括过度金属氧化物)的缘故。同时催化剂的用量及性状也是影响催化作用的重要影响因素。
3、氯酸钾和二氧化锰的最佳用量比
根据实验,氯酸钾和二氧化锰的用量比为3:1(质量比)时,氧气产生的速度最快。若二氧化锰的用量过少,它与氯酸钾的接触面积小,要使反应顺利进行,必须升高温度,,这样会使反应速度急剧加快而导致烟尘增加。二氧化锰的用量过多,又会使反应速度降低。应根据实际情况采用不同的配比。若考虑到学生实验的实际情况,可以将氯酸钾和二氧化锰的用量比改为6:1(质量比),使反应速度适中,便于氧气的收集和利用,减少浪费。
4、氯酸钾分解制氧时白色烟雾的产生与除去
用氯酸钾和二氧化锰制氧时,常常会出现白色烟雾,经分析白烟中含有和两种阴离子,可能由于氯酸钾和氯化钾气化后在气相空间凝固,还可能由于氧气泡和熔化物形成飞沫带出成烟。雾可能是少量氯气与水反应生成的遇到空气中的水分形成了盐酸雾滴。
除去白烟的方法:可用水洗、静置或在导管口塞一小段疏松的棉花加以过滤。还可以使氧气通过溶液来使之净化。
5、铁丝在氧气中燃烧为什么会火星四射
在化学反应中,凡是在固体或液体内部能产生气体,其压强能推开其包围物,就可以形成爆裂物。如果温度足够高,我们就可以看到火星四射。我们实验使用的铁丝不是纯铁,铁丝中含有一定量的碳(其中还包括微量的硫、磷),碳的存在使铁容易燃烧。在点燃的铁丝上,在氧气能够到达的浅表面繁盛碳与氧气直接生成二氧化碳的反应。稍深一点的地方,由于熔融状态物质的流动性,碳与新生成的铁的氧化物反应生成二氧化碳,二氧化碳气体使体积迅速膨胀,推动周围的熔化物向四周飞溅,于是我们便看到火星四射的实验现象。
6、高锰酸钾制取氧气的注意事项
高锰酸钾受热易分解,用高锰酸钾分解法制备氧气,不必加入催化剂,反应平稳,操作简便,但由于高锰酸钾中的氧不能全部放出,故利用率较低。实验时所用高锰酸钾必须纯净,不能含有还原性杂质。为了保证安全,可在实验前先取少量加热进行检验。
因为高锰酸钾固体的粉末较细,容易被反应产生的氧气吹带到导管中,可在反应管的管口处放一些棉花。
7、过氧化氢制取氧气的注意事项
过氧化氢分解法制氧气,不需要加热且反应迅速,在操作时过氧化氢宜用分液漏斗逐滴滴入,若液体很快上升,容易逸出,这时可将导管一端从水中取出,等待液面下降时再收集气体。
由于30%的过氧化氢对皮肤有强烈的腐蚀性,使用时要特别小心。实验中一般采用10%-15%的过氧化氢,以防反应过于剧烈而引起爆炸事故。


