请你思考
已知两瓶丢失标签的无色溶液,一瓶为HNO3,另一瓶为HCl你有哪些方法能鉴别它们?
1、硝酸的重要转化关系
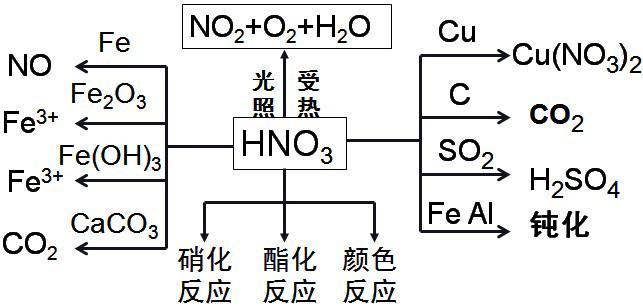
特别提醒
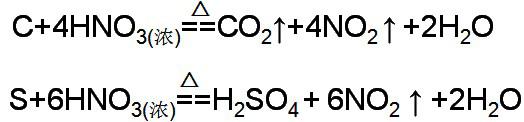
1、硝酸与非金属单质反应时,非金属单质一般氧化为最高价氧化物或其对应的水化物,硝酸只表现为氧化性,完全转化为还原产物。
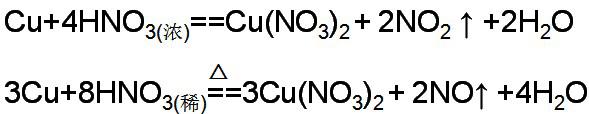
2、足量硝酸与金属单质时,金属单质一般氧化为高价的金属硝酸盐,硝酸既表现为氧化性又表现出酸性。浓硝酸的还原产物为NO2 ,稀硝酸的还原产物NO
3、金属与一定体积的浓硝酸反应时,开始时产生二氧化氮,随着反应中硝酸的消耗,其浓度逐渐减小,产生一氧化氮气体,故最后所得气体为NO和NO2的混合气。
此时如果金属有剩余,在溶液中加入稀硫酸或稀盐酸,金属会继续溶解。
4、铁具有可变化合价,过量的铁与硝酸反应时,由于会发生Fe + 2Fe3+ = 3Fe2+,所以最终生成硝酸亚铁。
对“恰好完全反应”的理解是铁和硝酸都不剩余。假定硝酸的量一定,则与铁完全反应时生成物有三种可能,(1)只生成Fe3+、(2)只生成Fe2+、(3)Fe3+和Fe2+的混合物,而涉及该问题的试题往往要用极端假设法解决。
(5)与指示剂作用
稀硝酸与石蕊试液变红,一段时间后不褪色。浓硝酸与石蕊试液变红,一段时间后会褪色。
2、硝酸与金属反应的相关计算规律
硝酸与金属反应时,金属被氧化生成金属阳离子,硝酸被还原为低价氮的化合物。所遵循的规律必须符合三个守恒:
①电子得失守恒:金属失去的电子总量,等于硝酸得到的电子总量;根据这个守恒,可求出氮元素被还原后的价态,根据价态确定生成物。
②元素守恒:即溶液的NO3-和释放出的NO(或NO2)中N的物质的量之和等于原HNO3的物质的量;
③溶液中要符合电荷守恒,Mn+和H+所带正电荷总数应等于NO3-所带负电荷总数。(因为这种溶液中OH-浓度很小,可被忽略)


