例1、锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性小组对废旧锂离子电池正极材料(Li2MnO4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
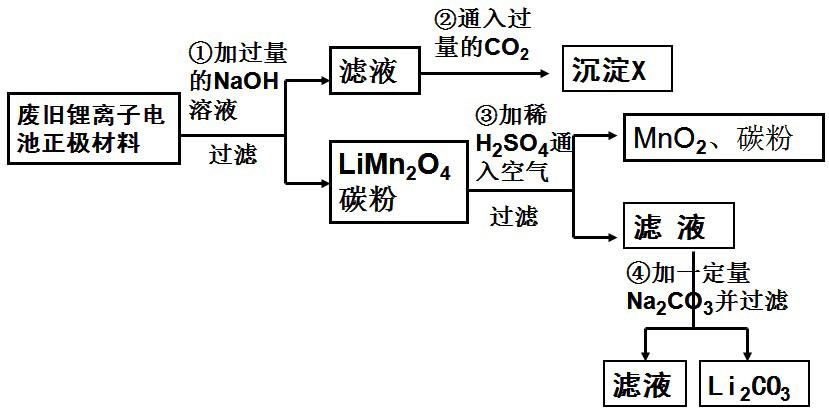
(1)第②步反应得到的沉淀X的化学式为( )。
(2)第③步反应的离子方程式是 ( )。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有( )。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:( )。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1g,第③步反应中加入20.0mL3.0mol·L-1的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有( )g Na2CO3参加了反应。
例2、亚硫酸盐是一种常见食品添加剂。为检测某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:
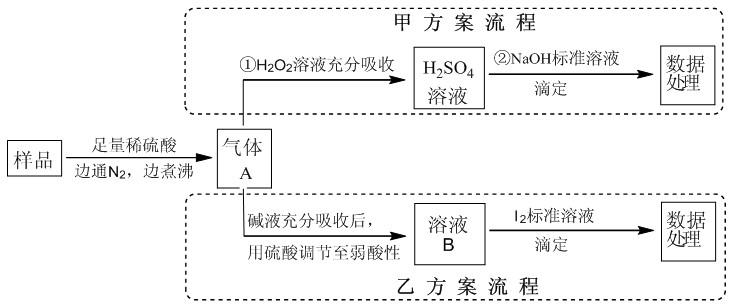
(1)气体A的主要成分是__________,为防止煮沸时发生暴沸,必须先向烧瓶中加入__________;通入N2的目的是____________________。
(2)写出甲方案第①步反应的离子方程式______________________________。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是__________。
(4)若用盐酸代替洗硫酸处理样品,则按乙方案实验测定的结果__________(填“偏高”、“偏低”、“不影响”)。
(5)若取样品w g,按乙方案测得消耗0.01000 mol·L-1I2溶液V mL,则1 kg样品中含SO2的质量__________g(用含w,V的代数式表示)。
例3、如图,已知反应①、③是工业生产中重要反应,D、E常温下为气体,X常温下为无色液体,H与E相对分子质量关系为 Mr(H)-Mr(E)=34,C焰色反应呈黄色 。
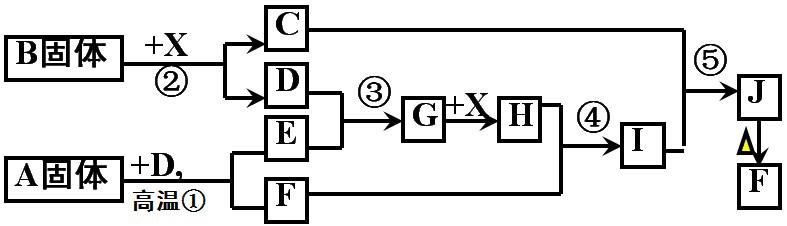
(1)B的化学式:_____,电子式:_________,其中包含的化学键有:____________________
(2) 反应④的离子方程式:________________________________
(3) 反应⑤的化学方程式:_________________________________
答案:
例1、(1) Al(OH)3
(2)4LiMn2O4 + O2 + 4H+ =4Li+ + 8MnO2 + 2H2O
(3)漏斗玻璃棒烧杯、滤纸破损、滤液超过滤纸边缘等(其它合理答案均可)
(4)6.36或6.4
计算过程:
4LiMn2O4 + O2 + 4H+ =4Li+ + 8MnO2 + 2H2O
从上述方程可看出:
LiMn2O4 ~ 0.5H2SO4 ~Li+,18.1gLiMn2O4,即0.1mol,只消耗0.05molH2SO4,剩余硫酸与锂离子共需要Na2CO3(0.01+0.05)mol,即6.36g
例2、(1)SO2、N2 、碎瓷片(或沸石)、将生成的SO2全部赶出
(2)SO2+H2O2 =2H++SO42-
(3) 向滴定管注入少量NaOH标准液,倾斜转动滴定管润洗整个滴定管内壁,然后将润洗液从下端尖嘴处放出,重复操作2~3次
(4)无影响。
解析:用盐酸代替硫酸,生成的SO2气体中混有少量HCl,因SO2用碱液吸收后需再用盐酸调节溶液至弱酸性,因此混合气体中含有HCl,对实验结果无影响。
(5)0.64V/w
反应为H2O+SO32-+I2 = SO42-+2I-+ 2H+
n(SO2)=n(SO32-)=n(I2)
=0.010 00 mol·L-1 ×V×10-3 L
=V×10-5 mol,因此1 kg样品中含SO2的质量为:
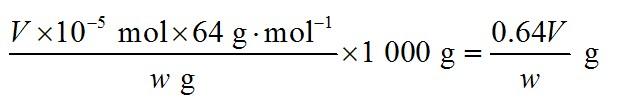
例3、(1)Na2O2、![]() 、(离子键、非极性键(或共价键))
、(离子键、非极性键(或共价键))
(2)Fe2O3 + 6H+ = 2Fe3++ 3H2O
(3)Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4


