考点精讲
一、卤素的原子结构
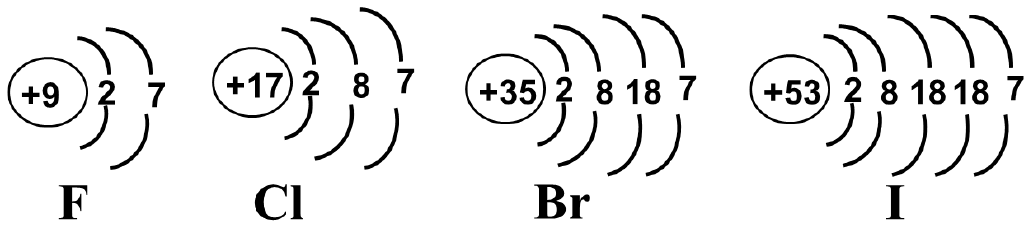
结论:卤素均较易得到e-达到8e-稳定结构,显示出较强的氧化性。
二、卤素单质在性质上的差异及递变规律
1、物理性质
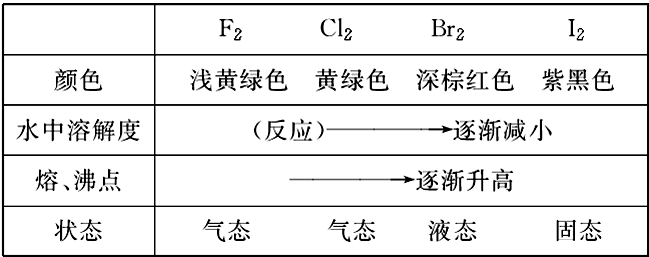
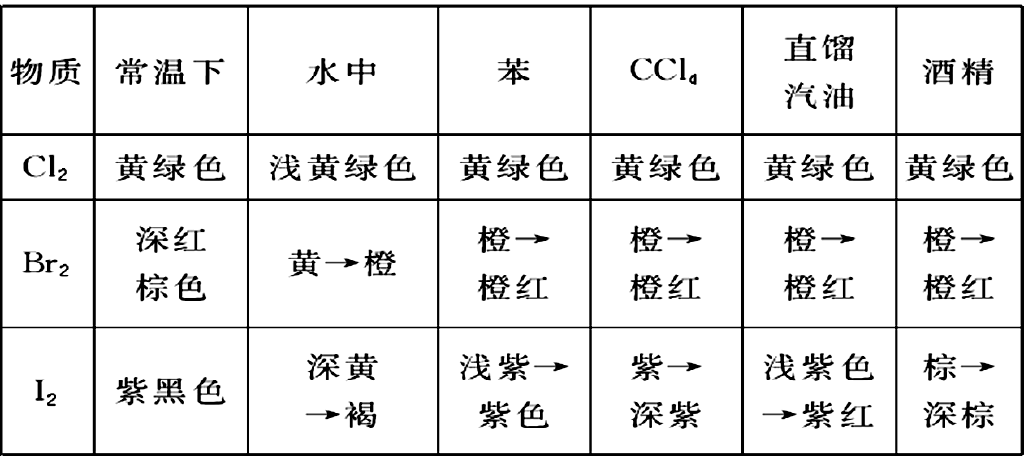
附:卤素单质在不同溶剂中的颜色
2、化学性质
由于从F→I,原子的最外电子层都有7个电子,都易得1个电子形成稳定结构,因此它们的化学性质具有极强的相似性;但从F→I原子半径越来越大,得电子能力逐渐减弱,故所形成的单质又具有递变性。
A.相似性
(1)除F2外,Cl2、Br2、I2都能与NaOH溶液反应,如:Br2与NaOH溶液反应的离子方程式:
Br2+2OH-=Bra-+BrO-+H2O。
(2)都能与金属反应生成卤化物,如:Na、Fe分别与Br2反应的方程式:
2Na+Br2=2NaBr 2Fe+3Br2=(△)2FeBr3
(3)与一些还原性离子的反应,如:Br2分别与Fe2+、SO32- :
Br2+2Fe2+===2Fe3++2Br-
Br2+SO32-+H3O===SO42-+2H++2Br2-。
B.递变性
(1)F2能与水剧烈反应,置换出水中的“O”;从Cl→I,与水反应越来越弱。
2F2+2H2O== 4HF+O2
(2)卤素单质和H2反应的条件及氢化物的稳定性:例如F2和H2在暗处即能爆炸(剧烈反应),H2和Cl2光照能爆炸,而Br2和H2则加热才能发生反应等,且生成的氢化物的稳定性从HF至HI越来越差。
H2+X2=2HX
(3)卤素间的置换反应:Cl2能从KBr、NaI溶液中置换出Br2、I2;Br2能从NaI溶液中置换I2,而不能从NaCl溶液中置换Cl2等。
如:Cl2 + 2KBr = 2KCl + Br2
(4)从F→I,单质的氧化能力越来越弱,对应阴离子的还原能力越来越强。
Fe+I2△(=====)FeI2
2Fe3++2I-===2Fe2++I2。
三、卤素及其化合物的特性
1.氟及其化合物
(1)非金属性最强,无正化合价;F-的还原性最弱。
(2)与H2反应在暗处即爆炸。
(3)2F2+2H2O ===4HF+O2.
(4)HF是弱酸;其它氢卤酸均为强酸.
(5)HF能腐蚀玻璃,常保存在铝制器皿或塑料瓶中;
(6)在HX中由于分子间可形成氢键,沸点最高.
(7)AgF溶于水,CaF2不溶于水
2.溴及其化合物
(1)Br2是深红棕色液体,易挥发.
(2)Br2易溶于有机溶剂.
(3)盛溴的试剂瓶中加水,进行水封,保存液溴不能用橡胶塞.
3.碘及其化合物
(1)淀粉遇I2变蓝色.
(2)I2加热时易升华.
(3)I2易溶于有机溶剂.
(4)食用盐中加入KIO3可预防甲状腺肿大.
4.卤化银
(1)AgF易溶于水,AgCl白色不溶于水,AgBr淡黄色不溶于水,AgI黄色不溶于水.AgCl、AgBr、AgI均不溶于稀硝酸.
(2)除AgF外,均有感光性,其中AgBr作感光材料,可用于照相.
(3)AgI可用于人工降雨.
(4)I2与Fe反应产生FeI3,其他卤素单质与Fe反应生成FeX3.
5.使溴水褪色的物质
(1)因萃取作用而使溴水褪色的物质:苯、CCl4、直馏汽油等有机溶剂.
(2)能与溴发生氧化还原反应的还原性无机化合物:H2S、SO2、Na2S、Na2SO3等.
(3)与溴水发生反应的金属,如Na、Mg、Al、Zn等.
(4)与溴水发生反应的碱性物质,如NaOH、Na2CO3等.
(5)加入活性炭等吸附剂,使溴水褪色.
四、卤素离子的检验方法
1. AgNO3溶液—沉淀法
未知液滴加AgNO3溶液和稀硝酸生成白色沉淀,则有则有I-,浅黄色沉淀,则有Br-,黄色沉淀,则有I-。
2.置换—萃取法
未知液加适量新制饱和氯水,振荡,加入CCl4(下层)或汽油(上层)振荡生成有机层,呈红棕色或橙红色表明有Br- ,呈紫色、浅紫色或紫红色表明有Cl-。
3.氧化—淀粉法检验I-
未知液双氧水加入适量新制饱和氯水(双氧水)振荡加淀粉溶液振荡蓝色溶液,表示有I-。


