请你思考
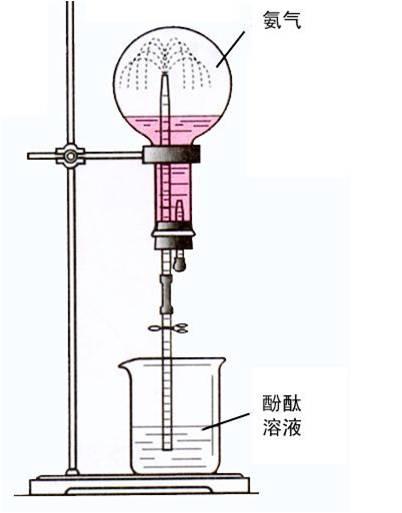
右图是经典的喷泉实验原理示意图,
NH3形成喷泉的原理是什么?
1、氨的结构与重要物理性质
(1)氨分子的结构
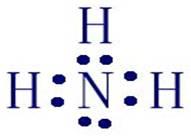
(2)氨气的重要物理特性
由于氨分子为极性分子,且N的电负性大,氨分子间及氨分子与水分子间均易形成氢键,因此氨气极易溶于水,也易液化。又因为氨的相对分子质量只有17,小于水;因此氨水的密度小于水,且氨水溶质质量分数越大,密度越小。
(3)引发喷泉实验的常见方法
①经典法:打开止水夹,挤出胶头滴管中的水。氨气极易溶解于水,致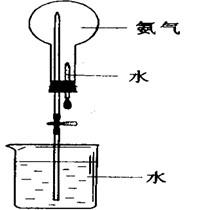 使烧瓶内气体压强迅速减小,在大气压的作用下,烧杯中的水喷入圆底烧瓶中。
使烧瓶内气体压强迅速减小,在大气压的作用下,烧杯中的水喷入圆底烧瓶中。
②热胀法:打开止水夹,用手(或热毛巾等)将烧瓶捂热。氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即有大量气体溶于水中,产生负压发生喷泉。
③用冰水浇注烧瓶,降低烧瓶内氨气的温度,使气体压强减小,水上升与氨气接触进一步减小压强形成喷泉。
小结:以上方法均为改变烧瓶内气体的压强,从而与大气压形成压强差引发喷泉。
请你思考
图中的锥形瓶中加入酒精,锥形瓶外放一水槽,水槽中加入冷水后,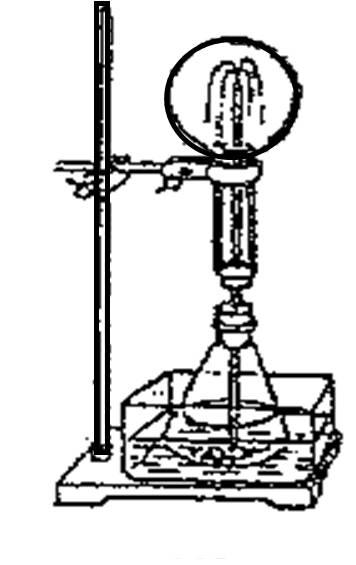 再加入足量的下列物质,结果也产生喷泉,水槽中加入的物质可以是( )
再加入足量的下列物质,结果也产生喷泉,水槽中加入的物质可以是( )
(A)氧化钙 (B)食盐
(C)硝酸钾 (D)硫酸铜
答案:A
喷泉实验的启示

请你思考
2、 以下各种尾气吸收装置中,适合于吸 已知两瓶丢失标签的无色溶液,一瓶为AgNO3,收易溶性气体,而且能防止倒吸的是 另一瓶为Al2(SO4)3用氨水能鉴别它们吗?
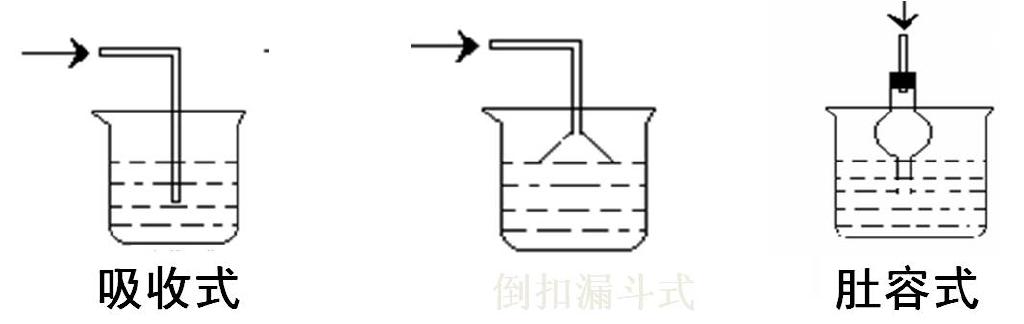
你知道了吗?
已知两瓶丢失标签的无色溶液,一瓶为AgNO3,另一瓶为Al2(SO4)3用氨水能鉴别它们吗?
答:能。在AgNO3,加入氨水时,先生成沉淀,继续加入氨水时,沉淀溶解,在Al2(SO4)3中氨水只生成白色沉淀。
3、实验室有两瓶丢失标签的白色固体,实验员只知道是NaCl和NH4Cl,你能设计一个实验方案帮她鉴别它吗?
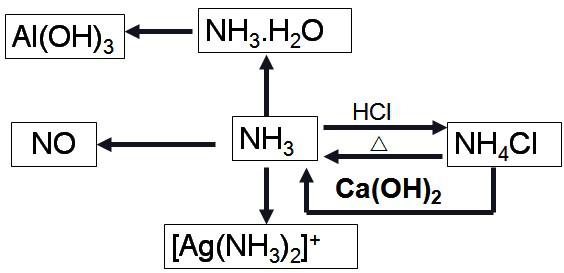
NH4+的检验方法

小结………铵盐“三解”
易溶解:均为易溶于水的白色晶体。
受热易分解:晶体受热易分解。
易碱解:和碱在加热的条件下,发生复分解反应,产生NH3 。
4、NH3的制备
(1)工业法-----人工固氮 (2)实验室法
![]()

操作要点及注意事项:
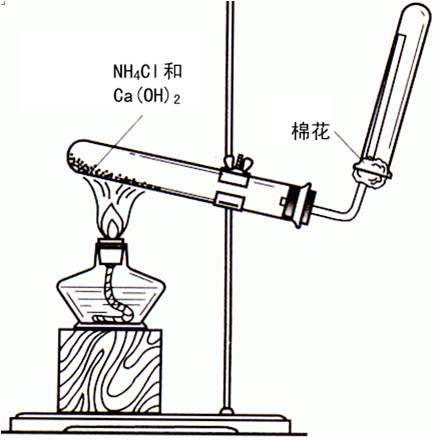
(1)只能用向下排空气法收集。
(2)常用碱石灰作干燥剂,不能用酸性干燥剂如浓H2SO4、P2O5等。也不用CaCl2干燥,原因是CaCl2和NH3加合生成CaCl2·8NH3。
(3)验满方法有:用湿润的红色石蕊试纸放在试管口,也可用玻璃棒蘸有浓盐酸,靠近试管口。
(4)不用NaOH代替消石灰。原因是:NaOH碱性强,加热时容易腐蚀试管。消石灰碱性相对弱,对试管的腐蚀较小,且比较疏松,氨气容易逸出。
(5)棉花的作用为防止气体对流,提高收集氨气的纯度;也可用来吸收尾气。
实验室中制氨气常用其它方法:
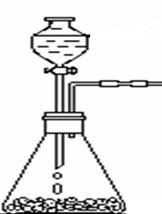
①加热浓氨水法
②浓氨水加碱石灰法
答案:
碱石灰吸水、溶解时放热,增大OH-浓度平衡逆移。


