氯气的制备
上一节
下一节
考点精讲
1.反应原理
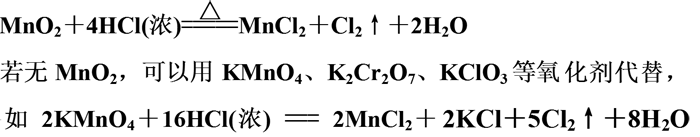
2.制备气体的类型
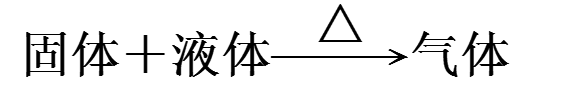
3.收集方法
向上排空气法或排饱和食盐水法。
4.净化方法
用饱和食盐水除去HCl,再用浓H2SO4除去水蒸气。
5.尾气吸收
用强碱溶液(如NaOH溶液)吸收。
6.验满方法
(1)将湿润的淀粉碘化钾试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满。
(2)将湿润的蓝色石蕊试纸靠近盛Cl2的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
(3)实验室制取Cl2时,常常根据氯气的颜色判断是否收集满。
7.装置展示:实验室制氯气装置如下
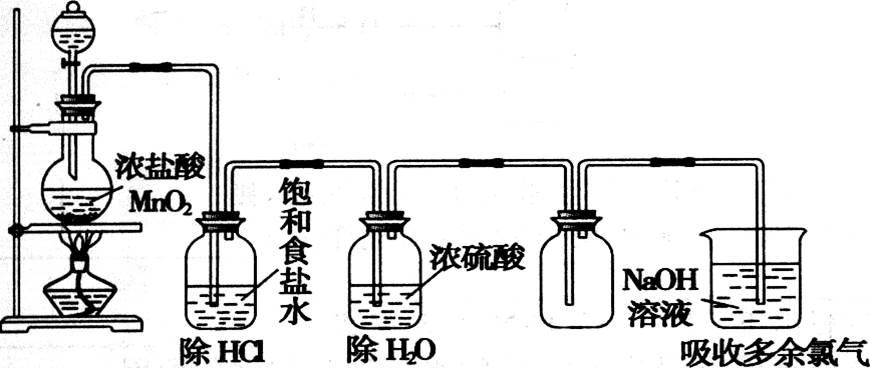
制取气体的实验装置一般包括四个部分:发生装置→净化装置→收集或性质验证装置→尾气处理装置。在组合装置制取气体时,可按此顺序选择需要的仪器和相应的药品,对有毒气体必须有尾气处理装置。
8.注意事项
(1)为了减少制得的Cl2中HCl的含量,所以加热温度不宜过高,以减少HCl的挥发.
(2))必须用浓盐酸,稀盐酸不反应.
(3)实验结束后,先使反应停止并排出残留的Cl2,再拆卸装置,避免污染空气.
(4)尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中含Ca(OH)2量少,不易完全吸收。


