请你思考
1、请你观察下列化学实验原理示意图,有何现象?用电离方程式或离子方程式解释原因?
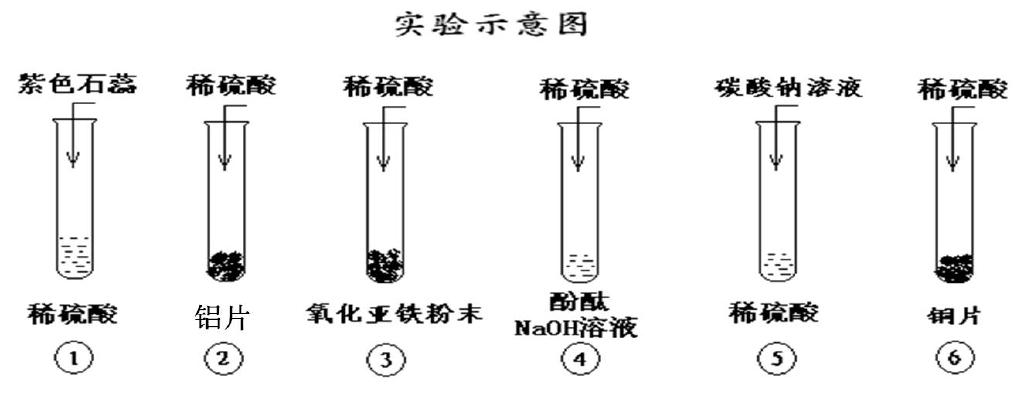
稀硫酸具有酸的通性
H2SO4= 2H+ + SO42-酸的通性(二元强酸):①溶液变红 ②2Al + 6H+ = 2Al3+ +3H2↑ ③FeO + 2H+ = Fe2+ + H2O ④H+ +OH- = H2O 溶液退色 ⑤CO32- +2H+ = CO2↑ + H2O ⑥不反应,活动顺序表氢后金属不能置换酸中氢
请你思考
2、今有两瓶失去标签的无色液体,只知其中一瓶是浓硫酸、一瓶是稀硫酸,你有哪些办法确认它们?
方法一:观察状态,粘稠油状的液体是浓硫酸。
方法二:根据密度,等体积的液体较重的是浓硫酸。
方法三:溶于水,放出大量热的是浓硫酸。
方法四:在两个大烧杯中分别加入一定量的两种液体,将充满水蒸气的两个小烧杯倒扣其中,水蒸气很快消失的是浓硫酸。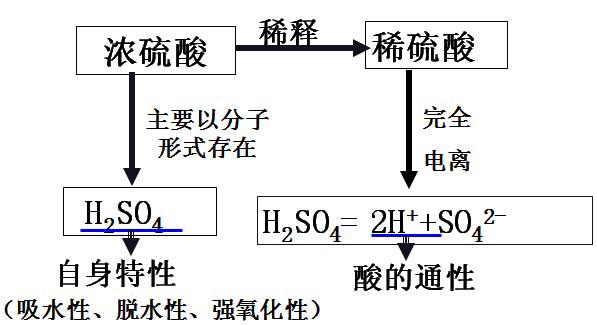
方法五:加入胆矾晶体,由蓝色变成白色的是浓硫酸;无现象的是稀硫酸。
方法六:各取少许加入蔗糖中,能使蔗糖碳化变黑的是浓硫酸。
方法七:加入铜片并加热,产生气体的是浓硫酸;无现象的是稀硫酸。
方法八:加入铁钉,使之钝化的是浓硫酸;有气体生成的是稀硫酸。
方法九:能蓝色石蕊试纸先变红后变黑的是浓硫酸;只变红的是稀硫酸。
浓硫酸的强氧化性
⑴常温下,(Fe、Al)遇浓硫酸发生“钝化”
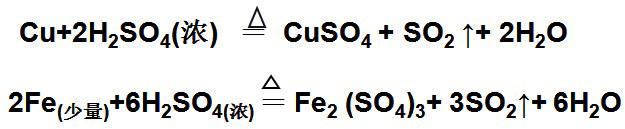
⑵与绝大多数金属反应(除Au、Pt):
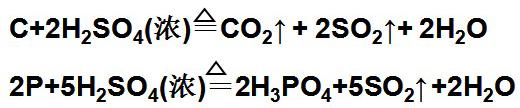
⑶与非金属单质反应:
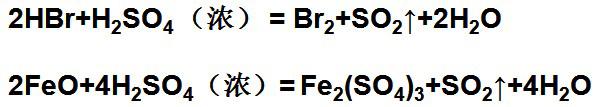
⑷与还原性化合物反应:
特别提醒
一定量的浓硫酸与足量不活泼金属反应时,硫酸不能完全反应,因为随着反应的进行,硫酸浓度变低不能再与金属反应。一定量的浓硫酸与足量活泼金属发生反应时,首先生成二氧化硫,然后生成氢气。
请你思考
3/有三位学生设计了三个方案,并都认为,如果观察到的现象和自己设计的方案一致,即可证明试液中有SO42-,试评述下述三种方案是否严谨,并说明理由。
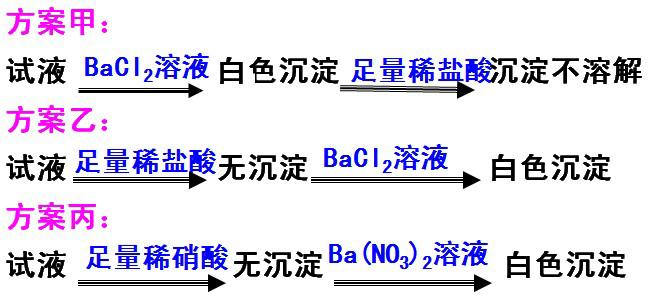
SO42-的检验
常常先用盐酸把溶液酸化,以排除CO32-、SO32-、Ag+等可能造成的干扰,再加入BaCl2溶液,根据是否有白色沉淀出现来说明原溶液中是否有SO42-存在。
注意:①不能用HNO3酸化
②钡盐不能用Ba(NO3)2溶液,因为在酸性条件下,SO32-、HSO3-、SO2等会被溶液中NO3-氧化。
SO32-的检验
方法1、向溶液中加入盐酸,将产生的气体通入品红溶液中红色褪去;SO32-+2H+=H2O+SO2↑
方法2:加入BaCl2溶液生成白色沉淀,加入盐酸,沉淀溶解并产生有刺激性气味的气体。
SO32-+Ba2+=BaSO3↓
BaSO3+2H+=SO2↑+ Ba2++H2O


