硅及其重要化合物
-
1 硅及其重要化合物
-
2 硅及其重要化合物
上一节
下一节
1.自然界存在游离态的硅吗?为什么?
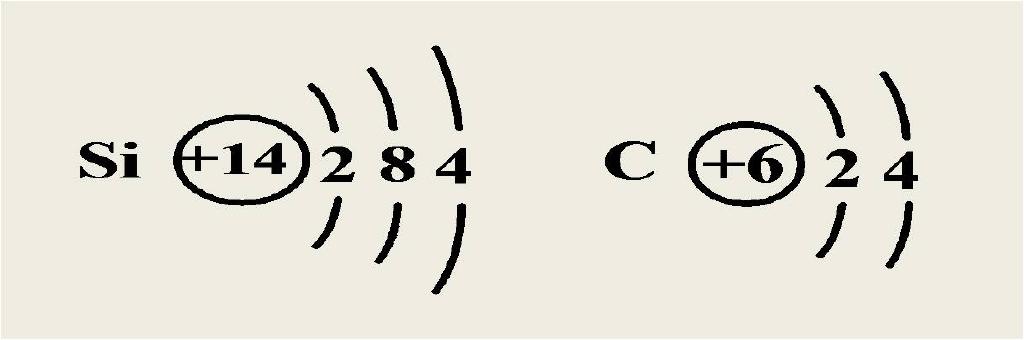
硅原子和碳原子的最外电子层均有4个电子,其原子既不易失去也不易得到电子,碳在自然界存在游离态,而硅却不存在游离态。
硅是一种亲氧元素,在自然界中它总是与氧相互化合的,因此硅都以化合态存在于自然界,主要以氧化物及硅酸盐的形式存在。
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。

2.硅单质有晶体和无定形两种,金刚石与晶体硅谁的硬度大?谁的熔点高?
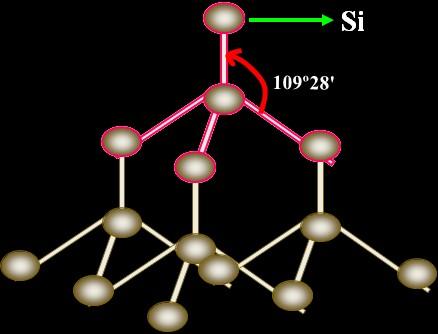
晶体硅的晶体结构与金刚石相似,也是由一个硅原子与4个硅原子结合形成正四面体,许多这样的正四面体向周围空间延伸形成空间网状的结构。但由于硅原子半径比碳原子半径大,所以,其熔沸点要比金刚石低,硬度要比金刚石小。
3.碳与硅是同一主族的相邻非金属,为什么CO2常温下是一种可溶入水的气体,SiO2却是难溶于水的高熔点固体?
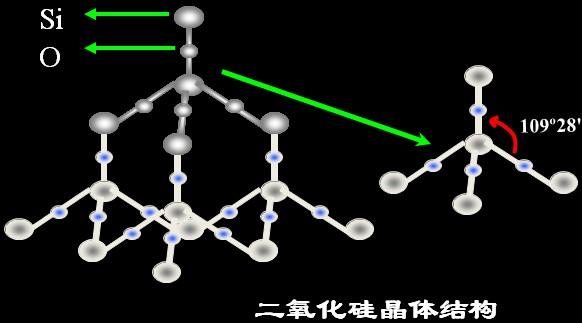
在二氧化硅晶体中,一个硅原子跟4个氧原子结合,同时每个氧原子跟两个硅原子结合。实际上,二氧化硅晶体是由硅原子和氧原子按1 :2的比例所组成的立体网状结构的晶体。它的熔点(1723℃)沸点(2230℃)高,硬度大,不导电,难溶于一些常见的溶剂。而二氧化却是分子晶体,因此它们的物理性质差异较大。
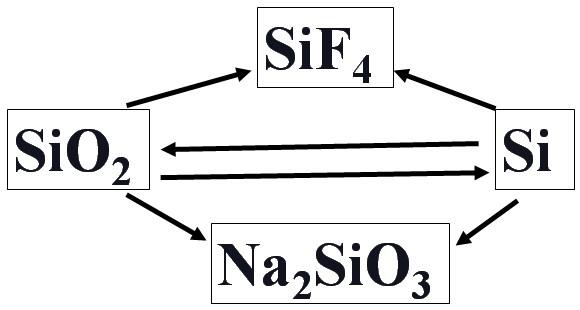
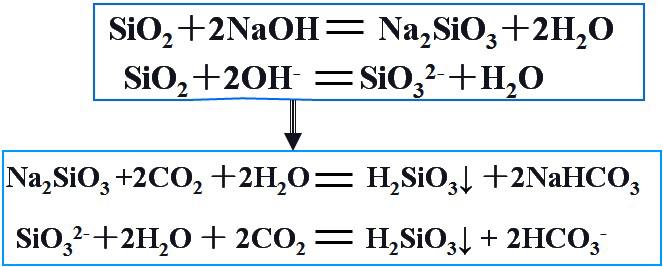
4.二氧化硅难溶于水,如何用二氧化硅制备硅酸?玻璃是一种易碎的物品,如何在玻璃上作画?

你知道了吗?
如何用二氧化硅制备硅酸?
5、碳、硅元素的特性
一般规律 | 碳硅的特性 |
| 非金属单质一般熔点低、硬度小 | 金刚石、晶体硅熔点高、硬度大 |
| 非金属单质一般为绝缘体 | 桂为半导体,常用语电子部件;石墨为电的良导体 |
| 非金属一般不与强碱反应放出氢气 | Si+2NaOH+H2O=Na2SiO3+2H2↑ |
非金属一般不与非氧化性酸反应 | Si+4HF=SiF4↑+2H2↑ |
硅还原性大于碳 | |
一般情况下,较活泼金属能置换酸或水中的氢,而大多数非金属不能 | Si+4HF===SiF4↑+2H2↑ |
| 碱性氧化物+酸==盐+水 | SiO2是酸性氧化物,却能与氢氟酸发生反应:SiO2+4HF = SiF4↑+2H2O |
| 较强酸+较弱酸盐==较弱酸+较强酸盐(水溶液中) | 酸性:H2CO3>H2SiO3,却能发生如下反应:Na2CO3+SiO2== Na2SiO3+CO2↑ |
6、你知道硅肺病是怎么形成的吗?
SiO2---在日常生活、生产和科研有着重要的用途,但有时也会对人体造成危害。如果长期吸入含有二氧化硅的粉尘,就会患硅肺病(或矽肺病)。长期在二氧化硅粉尘含量较高的地方,如采矿、翻砂、喷砂、制陶瓷等场所的工作人员易患此病,要注意保护。


