1、铁的氧化物
氧化物 | 氧化亚铁 | 三氧化二铁 | 四氧化三铁 |
化学式 | FeO | Fe2O3 | Fe3O4 |
颜色状态 | (黑色)粉末 | (红棕色)粉末 | (黑色晶体)有磁性 |
溶解性 | 难溶于水 | 难溶于水 | 难溶于水 |
铁化合价 | +2 | +3 | +2,+3 |
稳定性 | 不稳定 | 稳定 | 稳定 |
与H+ | FeO+2H+=Fe2++H2O | Fe2O3+6H+== 2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
2、铁的氢氧化物
氢氧化物 | 氢氧化亚铁 | 氢氧化铁 |
化学式 | Fe(OH)2 | Fe(OH)3 |
颜色状态 | 白色固体 | 红褐色固体 |
溶解性 | 难溶于水 | 难溶于水 |
稳定性 | 很不稳定,易被氧化。 | 不稳定,受热分解 |
与H+反应 | Fe(OH)2+2H+==Fe2++2H2O | Fe(OH)3+3H+=Fe3++3H2O |
转化关系 | 4Fe(OH)2+O2+2H2O==4Fe(OH)3 | |
3、氢氧化亚铁的制备及注意事项
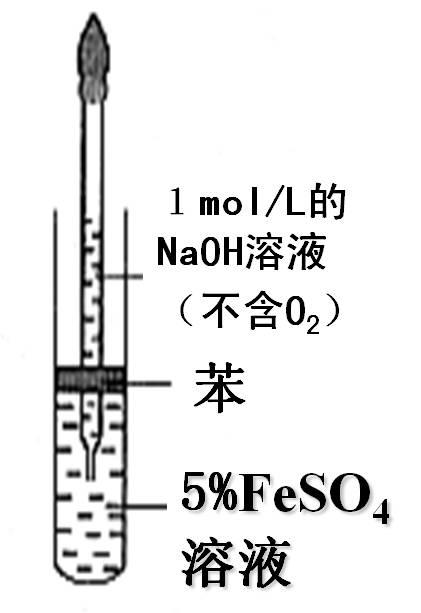
(1)直接滴加法 Fe2++ 2OH- = Fe(OH)2↓
注意事项:
①配制溶液的蒸馏水加热煮沸,除去O2.
②胶头滴管伸入到液面以下加入液体.
③溶液表面覆盖植物油(或苯),以隔绝空气.
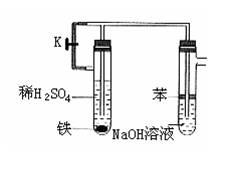
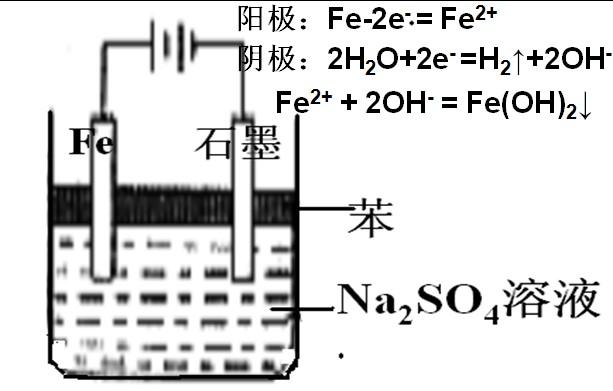
(2)集气排液法 (3)电解法
铁一定要接在电源的正极
4、不同价态铁的转化
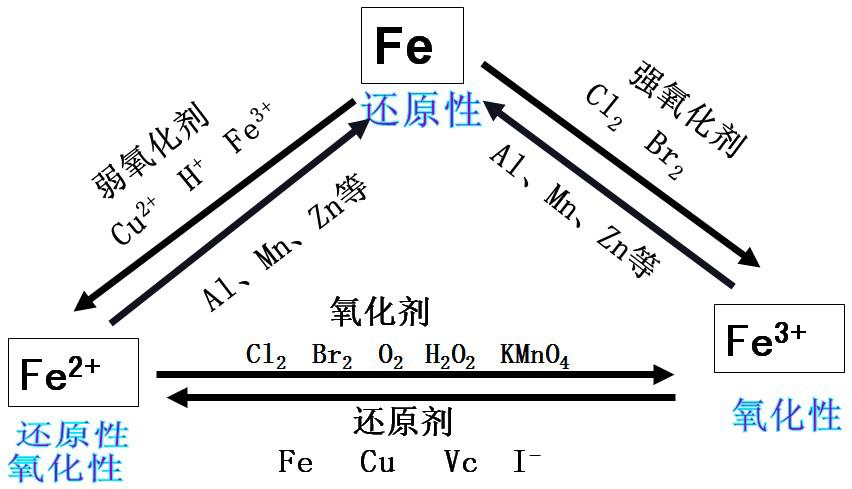
5、Fe、Fe2+、Fe3+转化关系的常见应用
(1)判断离子共存
①Fe2+、Fe3+均水解,与HCO3-、AlO2-、CO32- 等因水解相互促进在溶液中不能大量共存。
②Fe3+与S2-、I-、HS-、 SO32-,Fe2+与NO3-(H+)、ClO-、 MnO4-(H+)在溶液中因氧化还原反应不能大量共存。
(2)盐溶液的配制与保存
①Fe2+盐溶液:加少量铁粉,防止Fe2+被氧化;加少量相应的酸(硝酸亚铁例外),防止Fe2+水解。
②Fe3+盐溶液:加少量相应的酸防止Fe3+水解。
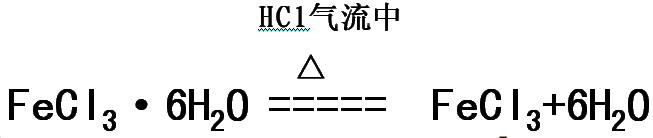
(3)制取Fe(OH)3胶体 (4)制备无水FeCl3
(5)氧化性、还原性关系
氧化性:Cl2>Br2>Fe3+>I2>S 还原性:Cl-<Br-<Fe2+<I-<S2-
如:少量氯气通入FeBr2中的离子方程应为:2Fe2++ Cl2 = 2Fe3+ + 2Cl-
过量氯气通入FeBr2中的离子方程应为:2Fe2++4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6Cl-
少量氯气通入FeI2中的离子方程应为:2I-+ Cl2 = I2 + 2Cl-
(6)除杂方法
①Fe2+(Fe3+):加Fe粉,过滤;②FeCl3(FeCl2):加氯水或H2O2;③FeCl2(CuCl2):加Fe粉,过滤。
特别提醒
Fe2+具有较强的还原性,Fe3+具有较强的水解能力,当pH>4时,Fe3+即可形成Fe(OH)3沉淀。欲除去某溶液中含有的Fe2+杂质时,一般先向该溶液中加入氧化剂(如H2O2),使Fe2+被氧化为Fe3+,然后通过加碱液调节pH,使Fe3+转化为Fe(OH)3沉淀除去。