考点精讲
1.自然界存在游离态的金属钠吗?实验室中的钠单质又是如何得到的呢?
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
由于金属钠在金属活动顺序表中位居第三位,非常活泼,通常情况下能跟O2、H2O等多种物质反应,因此自然界中不存在游离态的金属钠;只存在化合态的钠,主要以NaCl等盐的形式存在自然界中。
![]()
因为钠非常活泼,实验中的金属钠单质不是用热分解法、也不是用热还原法,而是用电解法制备。
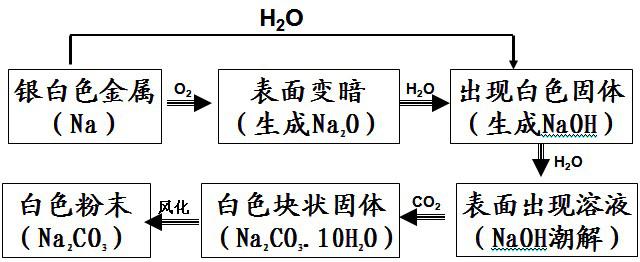
2.将一切开的金属钠片露置于空气中一段较长的时间,会发生哪些变化?最终会变成什么物质呢?
3.将一绿豆大小的钠块加入硫酸铜溶液中,推测会有什么现象,能生成金属铜吗?
钠浮在溶液的液面上,很快熔化成闪亮的小球,小球迅速地向四处游动,并发出“嘶嘶”的响声,越来越小,最后消失,整个过程中,钠球所到之处伴随有蓝色的沉淀产生,并可能有黑色的沉淀生成。
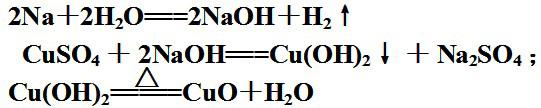
活动性很强的金属与盐溶液反应时,都应这样考虑。
注意:
若钠与熔化态盐反应时,金属钠可将活泼比它弱的金属置换出来:如 4Na + TiCl4= 4NaCl + 4Ti
4.将一绿豆大小的钠块分别加入稀硫酸溶液、乙醇、水中,你能推断它们反应的快慢吗?
金属钠与酸或水反应的实质均是与H+发生的氧化还原反应,由于水中的H+浓度比硫酸中小得多,因此钠在稀硫酸中的反应比水中剧烈;又由于乙醇中的羟基不能电离出H+,因此钠在乙醇中的反应温和得多。
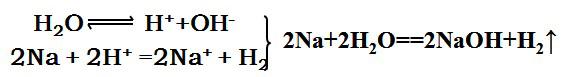
2Na + 2CH3CH2OH → 2CH3CH2ONa+ H2↑
5.有一同学在完成NaCl的焰色反应后,立即对硫酸钾溶液进行焰色反应,发现火焰呈黄色,于是他得出该硫酸盐是硫酸钠、而不是硫酸钾的结论,你认为对吗?
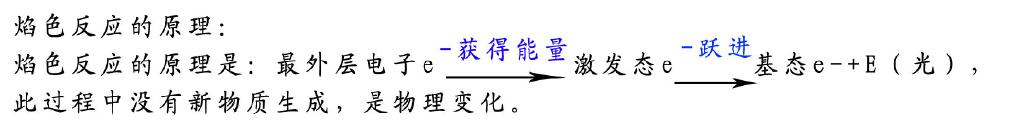
为了防止其它金属元素的干扰,金属丝在使用前要用稀盐酸将其表面物质洗净,然后在火焰上灼烧至无色,然后再进行下一实验。焰色反应实验过程中要用稀盐酸洗涤而不能选用稀H2SO4洗涤;这是因为金属氯化物在灼烧时易挥发,若用稀H2SO4洗涤金属丝,则由于硫酸盐的熔、沸点较高而难以挥发,会造成对后面实验的干扰。
该结论显然不准确,一方面该同学在进行NaCl的焰色反应实验后,没有进行洗涤、灼烧这一步骤,而且因为钾的火焰为紫色,需隔蓝色钴玻璃才能看清。在此需要提醒同学们:不是所有金属元素均能发生焰色反应,通常Mg、Al、Fe、Pt、Ni均无焰色反应,因此实验室经常可以用光洁的铁丝代替铂丝进行焰色反应实验。
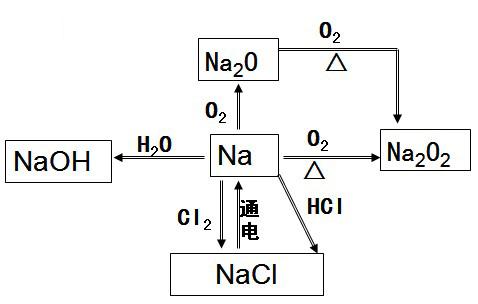
钠的转化