请你思考
1.生活和生产中使用的硫磺是人工制备的?还是直接来自大自然?
1、硫原子结构
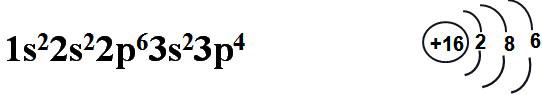
S基态核外电子排布式 S的原子结构简图
结论:硫较易得到2e-达到8e-稳定结构,显示出较强的氧化性。

硫在自然界广泛存在,但主要以化合态存在;游离态的硫大多存在于火山喷口附近或地壳的岩层里。
请你思考
2、实验时,如果试管内壁上粘有硫,你有哪些方法能把它除去?
方法1:可以用CS2进行洗涤。
硫的重要物理性质:硫(俗称硫磺)是一种黄色晶体,质脆,易研成粉末,熔、沸点较低,不溶于水,微溶于酒精,易溶于二硫化碳。
推论1:
从硫是非金属单质且熔、沸点较低,可以判断出硫是分子晶体
方法2:加入热浓NaOH溶液……
硫、硫的氧化物的重要转化关系
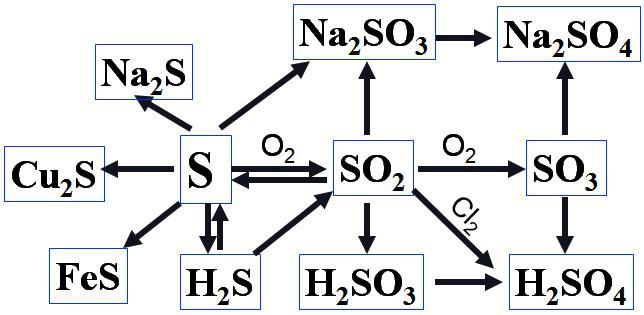
推论2:
比较硫与铁、铜反应及氯气与铁、铜反应生成物中金属元素的化合价,可判断氯原子得电子能力比硫原子强,从而推断出氯气的氧化性比硫强。
推论3:
在单质硫和二氧化硫中,首先它具有非金属和酸性氧化物的通性;从化合价角度看,硫单质的化合价是0价,SO2中硫元素为+4价,它们都处于中间价态,所以它们既有氧化性又有还原性,主要表现为还原性。
推论4:
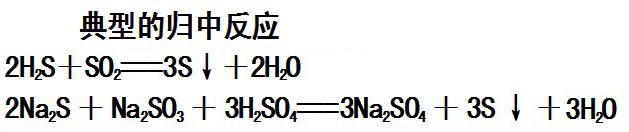
推论5:
相邻价态的粒子间不能发生氧化还原反应,如:硫的常见化合价为-2、0、+4、+6;因此S和H2S、 S和SO2、SO2和浓H2SO4间均不能发生氧化还原反应。同一元素不同价态发生氧化还原反应时,一定要有中间态存在。
推论6:

2、二氧化硫的特性-----漂白性
SO2+H20+有色物质→化合成不稳定无色物质→加热又变成有色物质
二氧化硫漂白具有暂时性和可逆性
漂白原理小结:
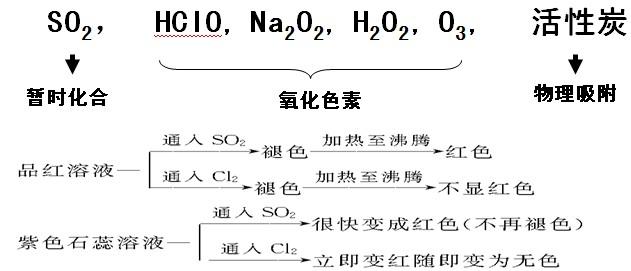
特别提醒
中学阶段能被SO2漂白的经典试剂里只有品红,而其他情况下,SO2使试剂褪色的情况则表现为其酸性氧化物的性质(如SO2使呈红色的酚酞试液褪色)或其还原性(如SO2使溴水、酸性高锰酸钾溶液褪色)


