1.自然界存在游离态的碳吗?为什么?
C 的结
 碳原子最外层有4个电子,既不容易得到电子也不容易失去电子,因此碳的性质比较稳定,在一定条件与其它元素形成化合物时,一般都是形成共价键。
碳原子最外层有4个电子,既不容易得到电子也不容易失去电子,因此碳的性质比较稳定,在一定条件与其它元素形成化合物时,一般都是形成共价键。
2.常见的游离态的碳有哪几种?它们的物理性质相似吗?
金刚石
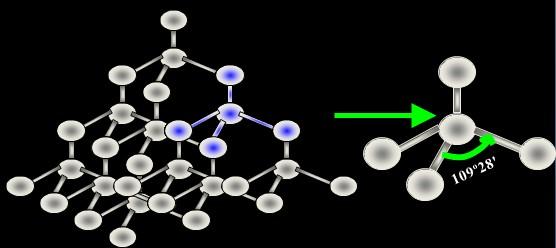
金刚石是一种具有空间网状结构的原子晶体,为正 四面体立体网状结构,金刚石的熔点(>3550℃)和 沸点(4827℃)都很高,硬度很大。
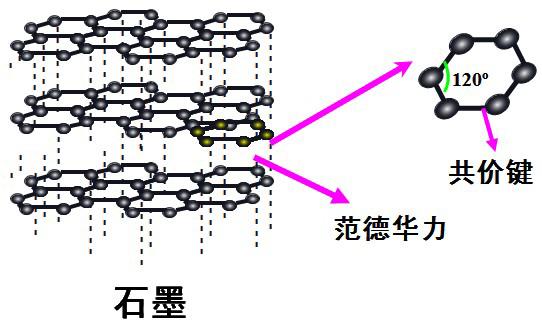 石墨是层状结构,在每一层内,碳原子排成六边形,每个碳原子与其它3个碳原子以共价键结合,形成平面的网状结构;在层与层之间,是以分子间作用力结合的。由于同一层的碳原子以较强共价键结合,使石墨的熔点很高 (比金刚石的还要高)。但由于层与层之间的分子间作用力很弱,容易滑动,使石墨的硬度很小。
石墨是层状结构,在每一层内,碳原子排成六边形,每个碳原子与其它3个碳原子以共价键结合,形成平面的网状结构;在层与层之间,是以分子间作用力结合的。由于同一层的碳原子以较强共价键结合,使石墨的熔点很高 (比金刚石的还要高)。但由于层与层之间的分子间作用力很弱,容易滑动,使石墨的硬度很小。
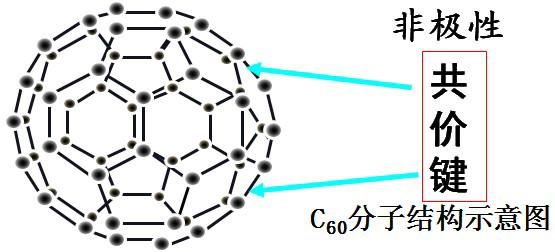
结构:笼状分子,固态时是分子晶体,熔沸点均不及石墨和金刚石,每个碳原子只跟相邻的三个碳原子形成共价键,60个碳原子构成球形,共32面体,包括12个五边形,20个六边形。
3.有人认为:人口的增长、人类大规模砍伐森林、甚至在北京开车,都会干扰海里的珊瑚生长,甚至造成珊瑚虫的死亡,你认为有道理吗?
请你参与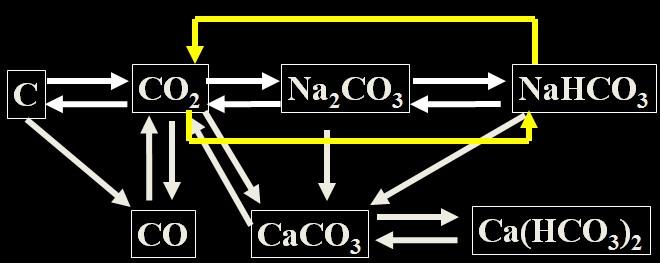
碳及其重要化合物的转化
请尽量思考更多的途径
你理解了吗?
珊瑚虫是海洋中的一种腔肠动物,它们可以从海水中获取Ca2+、CO32-经反应形成石灰石外壳
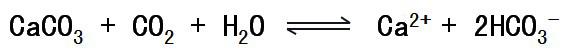
人口的增长、人类大规模砍伐森林、燃烧煤和其它化石燃料,都会造成空气中的二氧化碳含量升高,从而海水的二氧化碳含量升高,上述可逆过程向右移动,珊瑚虫不但不能形成石灰石外壳,原来形成的外壳都面临溶解。