一、影响分离纯化工艺设计的主要因素
1.含目的产物的起始物料的特点(speciality)
各种因素均对分离纯化技术和工艺有直接影响。这些因素包括:
①菌种类型及其代谢特性。包括菌种的各种生物学性质,产物和副产物种类、产物在细胞内所处的位置,表达方式,代谢物种类,产物类似物、毒物和能降解产物的酶类等;
②原材料和培养基的来源及其质量。
③生产工艺和条件。包括灭菌方法和条件,生产方式(连续、批式、半连续),生产周期,生产能力,工艺控制条件、因素及方式等;
④初始物料的物理、化学和生物学特性。包括产物浓度、主要杂质种类和浓度、盐的种类和浓度、溶解度、pH、粘度、流体力学性质和热力学性质等。
2.物料中杂质的种类和性质
杂质种类和性质包括相关性和非相关性杂质的含量、化学性质、结构、相对分子量、电荷性质及数量、生物学特性、稳定性、溶解度、分配系数、挥发性、吸附性能等。
3.目的产物特性
产物特性主要有化学、物理和生物学特性,包括化学组成、相对分子质量、等电点、电荷分布及密度、溶解度、稳定性、疏水性、扩散性、扩散系数、分配系数、吸附性能、生物学活性、亲和性、配基种类、表面活性等。
4.产品质量的要求
产品质量标准和用途对产品纯度、生物活性、比活的要求。包括允许的杂质种类和最大允许含量,特殊杂质的种类和最大允许量,以及杂质对使用的影响,产品剂型、贮存稳定性等。
二、选择分离纯化方法的依据
1.根据产物表达形式来选择
v分泌型表达产物的发酵液的体积很大、但浓度较低,必须在纯化前进行浓缩,可用沉淀和超滤的方法浓缩。
v产物在周质表达是介于细胞内可溶性表达和分泌表达之间的一种形式,它可以避开细胞内可溶性蛋白和培养基中蛋白类杂质,在一定程度上有利于分离纯化。
v为了获得周质蛋白,E.coli经低浓度溶菌酶处理后,可采用渗透压休克的方法来获得,能够回收到高质量的产物。
vE.coli细胞内可溶性表达产物破菌后的细胞上清,首选亲和分离方法。如果没有可以利用的单克隆抗体或相对特异性的亲和配基,一般先用离子交换色谱,处于极端等电点的蛋白质用离子交换分离能去掉大部分的杂质。
2.根据分离单元之间的衔接选择
应选择不同机制的分离单元来组成一套分离纯化工艺,尽早采用高效的分离手段,先将含量最多的杂质分离去除,将费用最高、最费时的分离单元放在最后阶段。
即通常:
①先选用非特异、低分辨的操作单元(如沉淀、超滤和吸附等),以尽快缩小样品体积,提高产物浓度,去除最主要的杂质(包括非蛋白类杂质);
②采用高分辨率的操作单元(如具有高选择性的离子交换色谱和亲和色谱);
③凝胶排阻色谱这类分离规模小、分离速度慢的操作单元放在最后。
v色谱分离次序的选择同样重要
v色谱次序能够提高分离效率,当几种方法连用时,最好以不同的分离机制为基础,经前一种方法处理的样品应能适合于作为后一种方法的料液,不必经过脱盐、浓缩等处理。
v如经盐析后得到的样品,不适宜于离子交换层析,但对疏水层析则可直接应用。
v离子交换、疏水及亲和色谱通常可起到蛋白质浓缩的效应
v凝胶过滤色谱常常使样品稀释
v在离子交换色谱之后进行疏水层析色谱就很合适,不必经过缓冲液的更换
v亲和层析选择性最强,但不能放在第一步:一方面因为杂质多,易受污染,另一方面,体积较大,需用大量的介质,因此亲和层析多放在第二步以后。
3.根据分离纯化工艺的要求来选择
分离纯化工艺应遵循以下原则:
(1)工艺条件应温和,具有良好的稳定性和重复性:不受或少受发酵工艺、条件及原材料来源的影响,在任何环境下使用都应具有重复性,明确需严格控制的步骤和技术
(2)尽可能减少组成工艺的步骤:步骤越多,产品的后处理收率越低,但必须保证产品的质量.
(3)组成工艺的各技术或步骤之间要相互适应和协调。
(4)在工艺过程中要尽可能少用试剂,以免增加步骤,或干扰产品质量。
(5)时间要尽可能短,因稳定性差的产物随工艺时间增加,生物活性收率会降低,产品质量会下降。
(6)必须高效、收率高、易操作,对设备条件要求低,能耗低
(7)具有较高的安全性:药品必须保证安全、无菌、无热原、无污染。
三、色谱法的优点和各类色谱的基本原理
v分离纯化主要依赖色谱分离方法。该法是设备简单,便于自动化控制和分离过程中无发热等有害效应。
v色谱技术分为:①离子交换色谱、②疏水色谱、③反相色谱、④亲和色谱、⑤凝胶过滤色谱、⑥高压液相色谱等。
v选择纯化方法尤其重要的根据是表面性质的差异。
1.离子交换色谱
ionexchange chromatography,IEC
v原理是通过带电的溶质分子与离子交换剂中可交换的离子进行交换,从而达到分离目的。分辨率高、容量大、操作容易,该法已成为多肽、蛋白质、核酸和许多发酵产物分离纯化的一种重要方法。
v离子交换剂是一类具有离子交换功能的高分子材料,功能基是由固定在骨架上的带电基团与可进行交换的能移动的离子两部分组成。二者所带电荷相反,可进行交换的离子称为反离子。
v反离子可与溶液中带同种电荷的离子进行交换,这种交换反应是可逆的,在一定条件下被交换的离子可能解吸,交换剂又恢复到原来的形式,离子交换剂通过交换和再生可以反复使用。
v纯化生物可以采用两种方式:
v一是将目的产物离子化,然后被交换到介质上,杂质不被吸附而从柱中流出,称之为“正吸附”,其优点是目的产物纯度高,起到浓缩作用,适于产物浓度低、工作液量大的溶液;
v二是将杂质离子化后交换,目的产物不被交换而直接流出,称之为“负吸附”,适用于目的产物浓度高的工作液,只可除去50%~70%的杂质,产物的纯度不高。
v影响因素
v①蛋白质的等电点和表面电荷的分布影响其离子交换的性能
v②交换基团和交换介质的种类、吸附和洗脱的条件(pH、离子强度、反离子)等。
v③等电点处于极端位置(pI<5或pI>8)的基因工程产物应首选离子交换色谱方法,往往一步即可除去几乎全部的杂质。
2.反相色谱和疏水色谱
A. 原理
v根据蛋白质疏水性的差异来分离纯化。
v反相色谱是利用溶质分子中非极性基团与非极性固定相之间相互作用力的大小,以及溶质分子中极性基团与流动相中极性分子之间在相反方向作用力的大小的差异进行分离。
v进行生物大分子反相色谱分离时,常用的固定相为硅胶烷基键合相;流动相多采用低离子强度的酸性水溶液,并加入一定比例的能与水互溶的乙腈、甲醇、异丙醇等有机溶剂。
v由于固定相骨架的疏水性强,吸附的蛋白质需要用有机溶剂才能洗脱下来。
Ø疏水色谱原理与反相色谱相似,主要是利用蛋白质分子表面上的疏水区域(非极性氨基酸的侧链)和介质的疏水基团(苯基或辛基)之间的相互作用,无机盐的存在能使相互作用力增强。所用介质表面的疏水性比反相色谱所用介质的弱,为有机聚合物键合相或大孔硅胶键合相,流动相一般为pH6~8的盐水溶液。
v在高盐浓度时,蛋白质分子中疏水性部分与介质的疏水基团产生疏水性作用而被吸附;
v盐浓度降低时蛋白质的疏水作用减弱,目的蛋白质被逐步洗脱下来,蛋白质的疏水性越强,洗脱时间越长。
v与反相色谱相比,疏水色谱回收率较高,蛋白质变性的可能性小。
B. 二者比较
v反相色谱和疏水色谱的差异在于前者在有机相中进行,蛋白质经过反相流动相与固定相作用有时会发生部分变性,而且后者通常在水溶液中进行,蛋白质在分离过程中一般仍保持其天然构象。
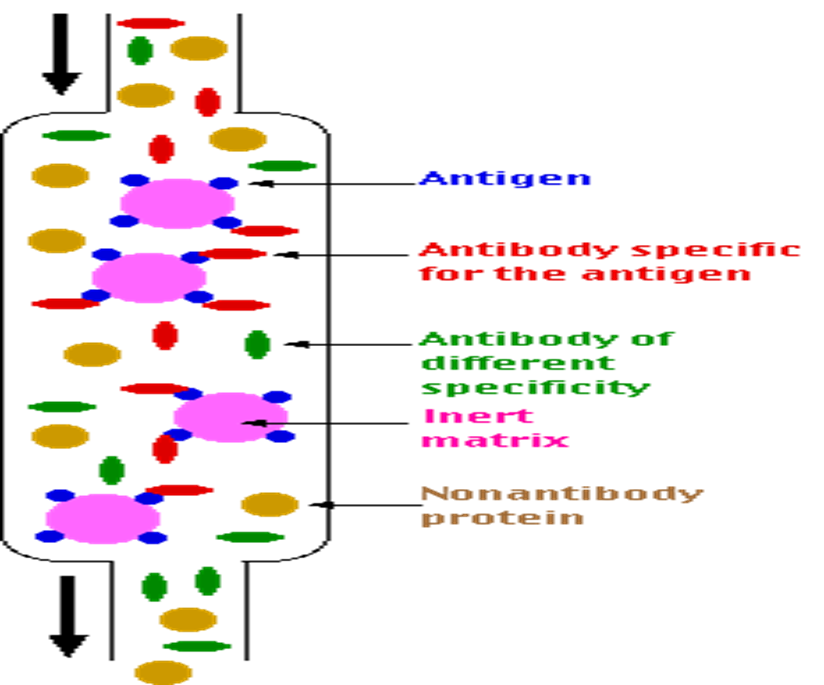
3.亲和色谱(affinitychromatography)
1)基本概念(basic concept)
v亲和层析是利用待分离物质与其特异性配基之间特异性的亲和力进行分离的一类特殊的层析技术。
vTypicallyoffers purities>95% in one step。
v配基(ligand) :被固定在基质上的分子称为配基,配基和基质是以共价键结合的。
v基质(matrix):亦称为载体(vector),是构成固定相的骨架 。
2)亲和层析有如下特点(CharacteristicsofAffinityChromatography)
Ø纯化过程简单、迅速;
Ø分离效率高;
Ø产物纯度高;
Ø必须针对某一分离对象制备专一的配基及寻求稳定的层析条件。
因此应用范围受到一定的限制。
3)亲和层析的基本原理
(Mechanism of Affinity Chromatography)
①亲和的一对分子中的一方以共价键形式与不溶性载体相连作为固定相吸附剂。
②当含有混合组份的样品(流动相)通过此固定相时,只有和固定相分子有特异亲和力的物质,才能被固定相吸附结合,其它没有亲和力的无关组份就随流动相流出。
③然后改变流动相成份,将结合的亲和物洗脱下来。(见Fig1、Fig2)。
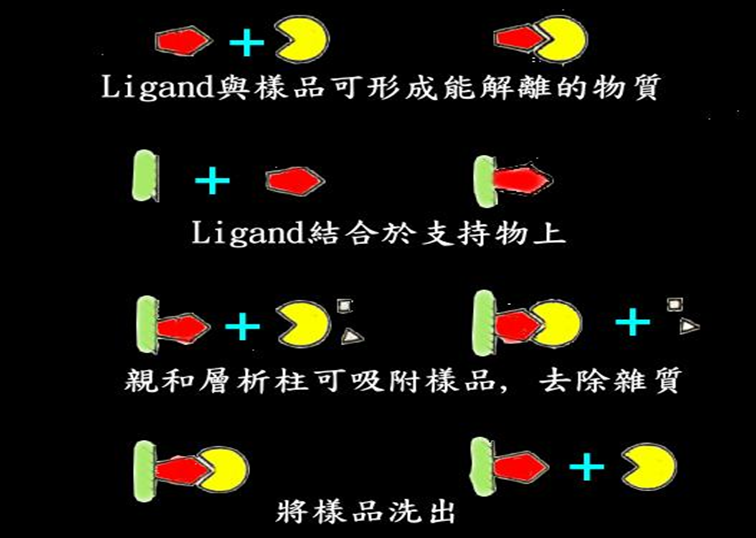
( Fig1. Mechanism of AC)
(Fig2. Mechanism of AC)
3.亲和色谱(affinitychromatography)
4)配基的种类 (sorts of ligand)
v抗原与抗体。vDNA与互补DNA或RNA(cDNA、mRNA)。
v酶与其底物。
v激素与其受体。v维生素与结合蛋白。v糖蛋白与植物凝集素。
5)亲和层析载体的性质与选择
v亲和层析载体的选择(selectionof vectors)
v多孔的立体网状结构,能使被亲和吸附的大分子自由通过。
v颗粒均匀,具有良好的流速。
v具有惰性,尽量减少非专一性吸附。在温和的条件下 能与配基共价偶联。
6)常用的亲和层析载体
(Vectors of Affinity Chromatography)
v纤维素(cellulose)
v葡聚糖凝胶(Sephadex)
v琼脂糖凝胶(Sepharose)
v聚丙烯酰胺凝胶(Bio-gel)
v多孔玻璃珠(Bio-Glass)
v其它新型载体(Other gels)
7)亲和层析配基的选择(Selection of ligand)
1.纯化对象和配基之间必须有较强的亲和力。
2.但亲和力太高也是有害的,因为在解离配 基复合物时所需的条件就要强烈,这样可能使生物分子变性。
3.配基必须具有适当的化学基团,可用于和载体相连,同时又不影响配基与生物分子之间的亲和力。
8)载体、配基、目的物的连接
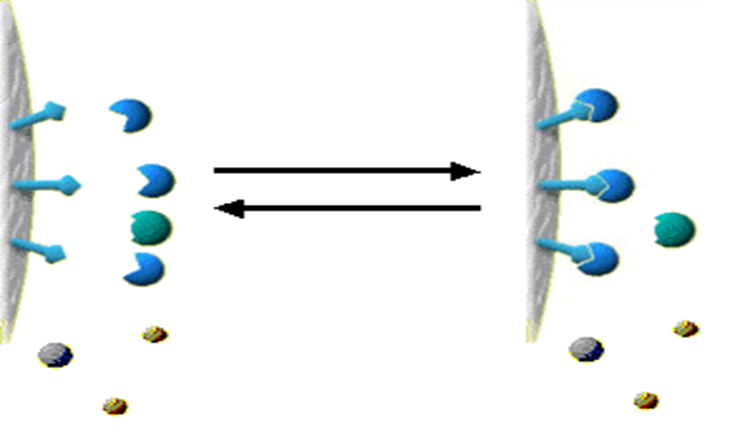
Fig AC relies upon a reversiblehighly
specific binding reaction.
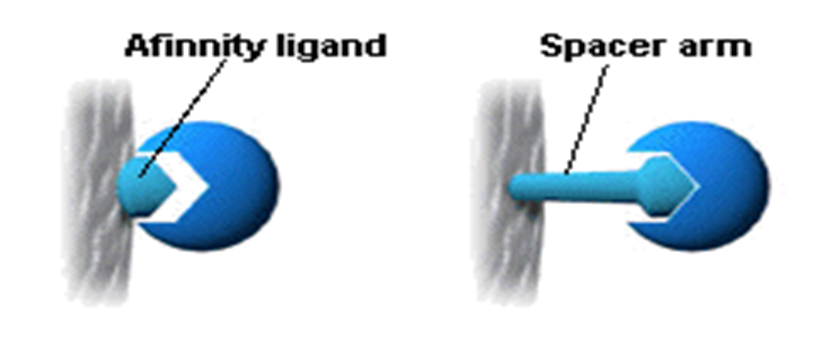
A spacer is sometimes used to ensure fullaccessibility of the affinity ligand.
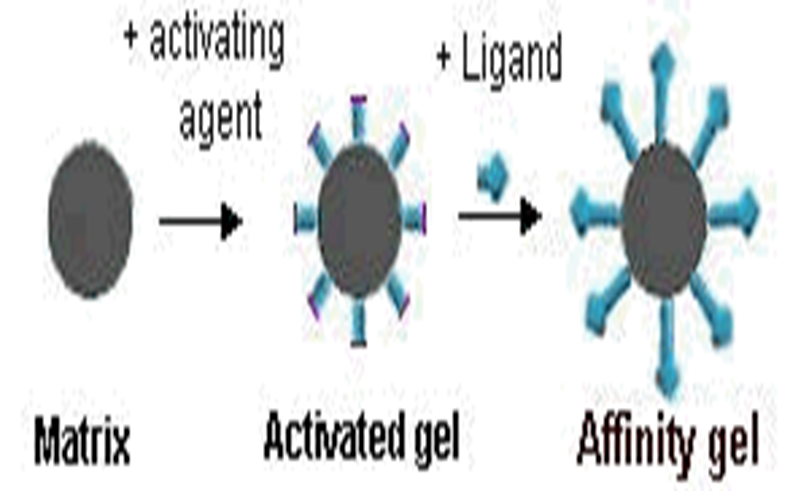
Fig Principle of preparing AC
media
9)亲和层析的基本操作方法:
①平衡(Equilibration)
用平衡Buffer冲洗柱体,至基线平稳.
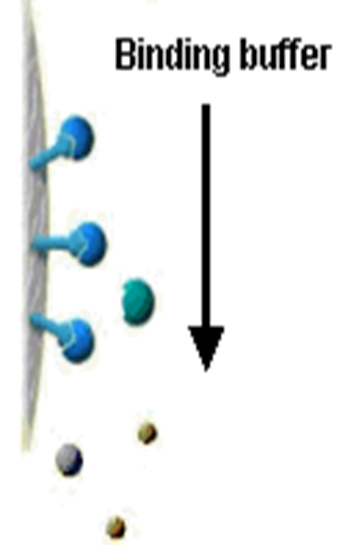
②样品上柱和冲洗(Sampleapplication and wash)
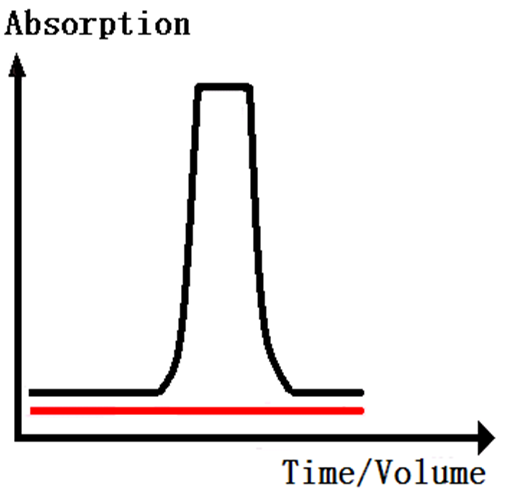
样品中的目的物与层析介质选择性的吸附,杂质不被吸附。用上样Buffer冲洗柱体,杂质被冲洗下来。形成杂质峰(见下图)。
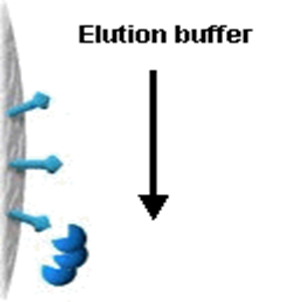
③洗脱(Elution)
选择适当的条件,将吸附在亲和介质上的目的物解吸下来(见下图)。
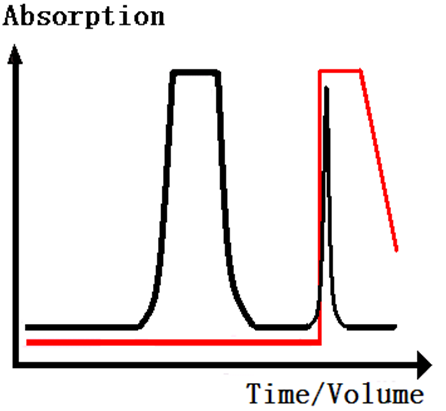
4.凝胶过滤色谱(gelfiltration chromatography)
v以具有空隙大小一定的多孔性凝胶作为分离介质,小分子能进入孔内,在柱中缓慢移动,而大分子不能进入孔内,快速移动,利用这种移动差别可使大分子与小分子分开。
v根据蛋白质的相对分子质量和蛋白质分子的动力学体积的大小差异,可以利用凝胶过滤来分离纯化目的蛋白。
v一是用于蛋白质分离过程中的脱盐和更换缓冲液
v二是用于蛋白质分子的分级分离,细胞因子的相对分子质量在1.5×104,很容易分离纯化;另一个应用是用于去除产物的多聚体及降解产物。


