第二节 T淋巴细胞
T淋巴细胞(T lymphocyte)来源于胸腺(Thymus),故称T细胞。成熟T细胞定居于外周免疫器官的胸腺依赖区,它们不但介导适应性细胞免疫应答,在胸腺依赖性抗原诱导的体液免疫应答中亦发挥重要的辅助作用,所以T细胞在适应性免疫应答中占据核心地位。T细胞缺陷既影响机体细胞免疫应答,也影响体液免疫应答,可导致对多种病原微生物甚至条件致病微生物(如白色念珠菌和卡氏肺囊虫)的易感性、抗肿瘤效应减弱等病理现象。
(一)T细胞的分化发育
骨髓多能造血干细胞(hematopoieticstemcell,HSC)在骨髓中分化成淋巴样祖细胞(lymphoidprogenitorcell)。HSC和淋巴样祖细胞均可经血液循环进入胸腺,在胸腺中完成T细胞的发育,成为成熟T细胞,再随血液循环进入外周淋巴器官,主要定居于外周淋巴器官的胸腺依赖区,接受抗原刺激发生免疫应答。整个过程中T细胞在胸腺中的发育至关重要。
1.T细胞在胸腺中的发育正常机体的成熟T细胞既要对多样性的非己抗原发生免疫应答,又要对自身抗原发生免疫耐受。为达到此要求,在胸腺T细胞的发育过程中,首先要经历其抗原识别受体(TCR)的基因重排,表达多样性的TCR,然后经历阳性选择和阴性选择。因此,T细胞在胸腺中发育的最核心事件是获得多样性TCR的表达、自身MHC限制性(阳性选择)以及自身免疫耐受(阴性选择)的形成。
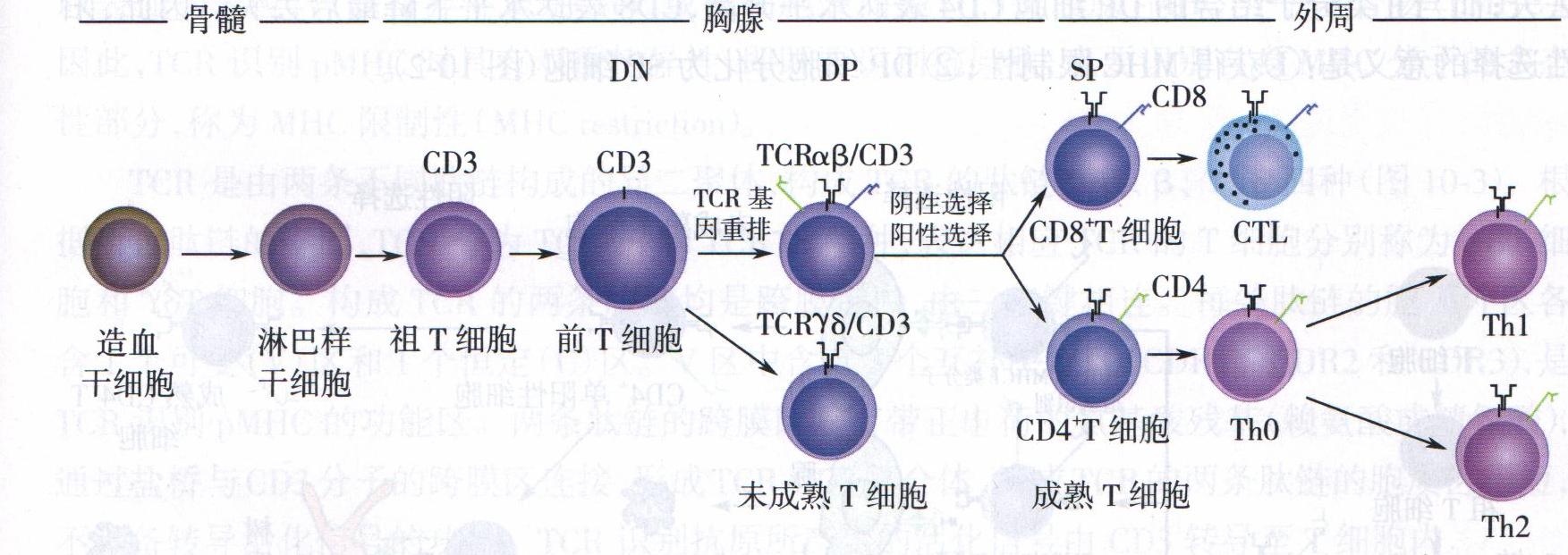
图 T细胞的发育
(1)T细胞在胸腺中的发育和TCR的重排在胸腺微环境的影响下,T细胞的发育经历淋巴样祖细胞→祖T细胞(pro-T)→前T细胞(pre-T)→未成熟T细胞→成熟T细胞等阶段,不同阶段T细胞表达不同的表型和功能。依据CD4和CD8分子的表达,胸腺中的T细胞又可分为双阴性细胞(doublenegative cell,DN细胞)、双阳性细胞(doublepositivecell,DP细胞)和单阳性细胞(singlepositivecell,SP细胞)三个阶段。
1)CD4- CD8--双阴性细胞阶段:pre-T以前的T细胞均为DN细胞。在IL-7等细胞因子的诱导下,pre-T增殖活跃,并表达CD4和CD8,细胞进入DP细胞阶段。
2) CD4+CD8+双阳性细胞阶段:DP的pre-T细胞停止增殖,开始重排α基因,并与β链组装成TCR(α:β TCR)。成功表达TCR的细胞即是未成熟T细胞。未成熟T细胞经历阳性选择并进一步分化为SP细胞。
3)CD4+CD8-或CD4-CD8+单阳性细胞阶段:SP细胞经历阴性选择后成为成熟T细胞,通过血液循环进入外周免疫器官。
(2)T细胞发育过程中的阳性选择 阳性选择(positiveselection)指在胸腺皮质中,未成熟DP细胞表达的随机多样特异性的TCR与胸腺上皮细胞表面的自身抗原肽-自身MHCⅠ类分子复合物或自身抗原肽-自身MHCⅡ类分子复合物相互作用。能以适当亲和力结合(阳性)的DP细胞成活并获得MHC限制性;不能结合或结合亲和力过高的DP细胞发生凋亡,凋亡细胞占DP细胞的95%以上。在此过程中,DP细胞分化为SP细胞:与I类分子结合的DP细胞CD8分子表达水平升高,CD4分子表达水平下降直至丢失;而与Ⅱ类分子结合的DP细胞CD4分子表达水平升高,CD8分子表达水平下降最后丢失。因此,阳性选择的意义是:①获得MHC限制性;②DP细胞分化为SP细胞(图。
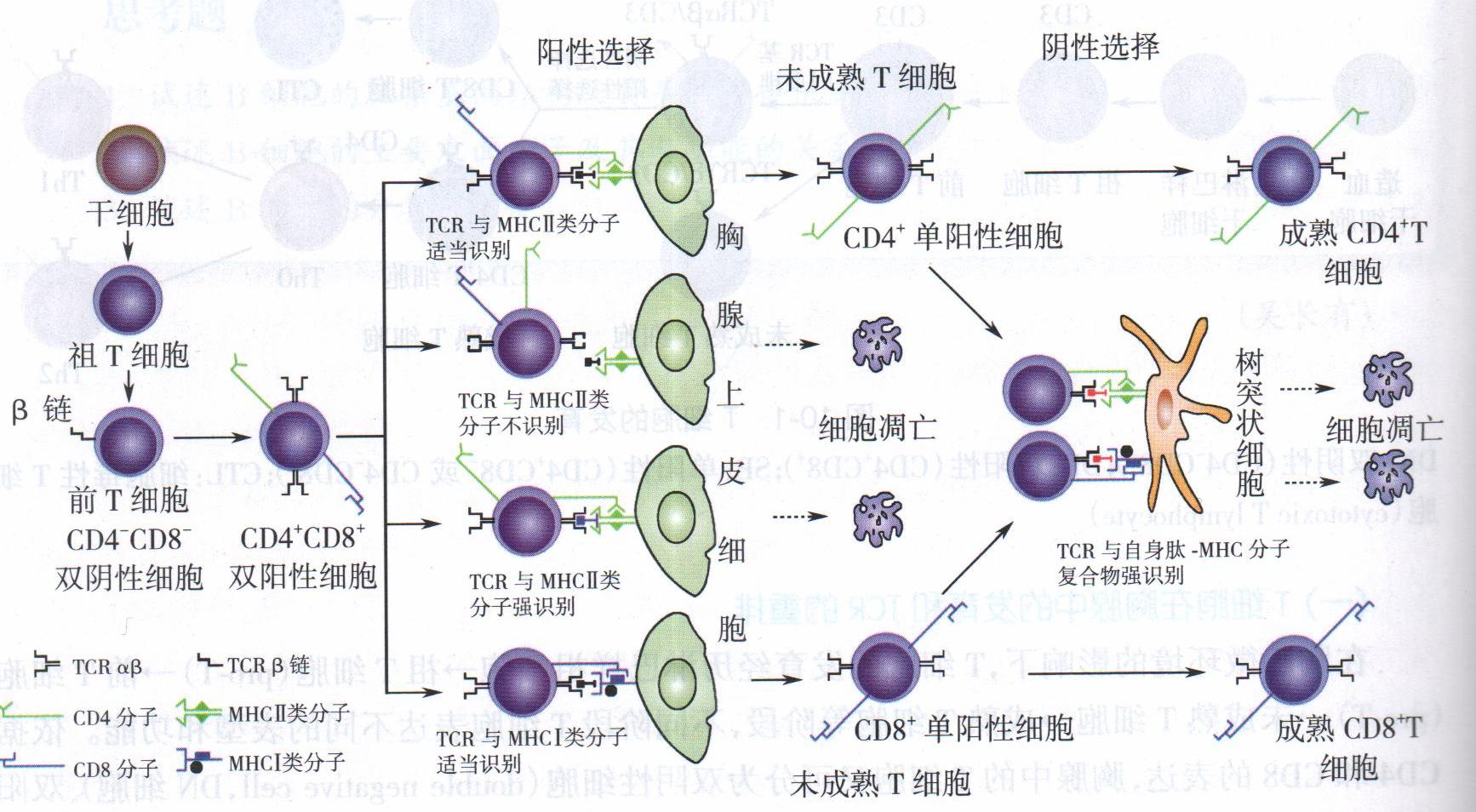
图 T细胞阳性选择和阴性选择
DP:双阳性(CD4+、CD8+);单阳性(CD4+、CD8-)(CD4-、CD8+)
(3)T细胞发育过程中的阴性选择 阴性选择(negativeselection)经过阳性选择的SP细胞在皮质髓质交界处及髓质区,与胸腺树突状细胞、巨噬细胞等表面的自身抗原肽-MHCI类分子复合物或自身抗原肽-MHCⅡ类分子复合物相互作用。高亲和力结合的SP细胞(即自身反应性T细胞)发生凋亡,少部分分化为调节性T细胞;而不能结合的SP细胞(阴性)存活为成熟T细胞并进入外周免疫器官。因此,阴性选择的意义是清除自身反应性T细胞,保留多样性的抗原反应性T细胞,以维持T细胞的中枢免疫耐受。
经过胸腺发育的CD4+T细胞或CD8+T细胞,进入胸腺髓质区,成为能特异性识别抗原肽-MHCⅡ类分子复合物或抗原肽-MHCI类分子复合物、具有自身MHC限制性以及自身免疫耐受性的初始T细胞,迁出胸腺,进入外周T细胞库。
2.T细胞在外周免疫器官中的增殖分化 从胸腺进入外周免疫器官尚未接触抗原的成熟T细胞称初始T细胞,主要定居于外周免疫器官的胸腺依赖区。T细胞的定居与它在胸腺发育中获得相应的淋巴细胞归巢受体(如L-选择素等黏附分子和CCR7等趋化因子受体)有关。T细胞在外周免疫器官与抗原接触后,最终分化为具有不同功能的效应T细胞亚群、调节性T细胞或记忆T细胞。
(二)T淋巴细胞的表面分子及其作用
T细胞表面具有许多重要的膜分子,它们参与T细胞识别抗原,活化、增殖、分化,以及效应功能的发挥。其中,一些膜分子还是区分T细胞及T细胞亚群的重要标志。
1.TCR-CD3复合物
(1)TCR的结构和功能:T细胞通过TCR识别抗原。与BCR 不同,TCR 并不能直接识别抗原表面的表位,只能特异性识别APC或靶细胞表面提呈的抗原肽-MHC分子复合物(pMHC),因此,TCR识别pMHC时具有双重特异性,即既要识别抗原肽,也要识别自身MHC分子的多态性部分,称为MHC限制性(MHC restriction)。
TCR是由两条不同肽链构成的异二聚体,构成TCR的肽链有α、β、γ、δ四种。根据所含肽链的不同,TCR分为TCRαβ和TCRγδ两种,表达相应TCR的T细胞分别称为αβT细胞和γδT细胞。构成TCR的两条肽链的胞质区很短,不具备转导活化信号的功能。TCR识别抗原所产生的活化信号由CD3转导至细胞内。
(2)CD3的结构和功能:CD3具有五种肽链,即γ、δ、ε、ζ和η链,均为跨膜蛋白,胞质区均含有免疫受体酪氨酸激活基序(immuno-receptor tyrosine-based activation motif,ITAM)。ITAM被细胞内的酪氨酸蛋白激酶磷酸化后,可通过一系列信号转导过程激活T细胞。因此,CD3分子的功能是转导TCR识别抗原所产生的活化信号。
2.CD4和CD8 成熟T细胞只表达CD4或CD8,即CD4+T细胞或CD8+T细胞。CD4和CD8的主要功能是辅助TCR识别抗原和参与T细胞活化信号的转导,因此又称为TCR的共受体。其中CD4识别MHCⅡ类分子,而CD8识别MHCⅠ类分子。
3.共刺激因子 共刺激因子是为T(或B)细胞完全活化提供共刺激信号的细胞表面分子及配体。
初始T细胞的完全活化需要两种活化信号的协同作用。第一信号(或抗原刺激信号)由TCR识别APC提呈的pMHC而产生,经CD3转导信号,CD4或CD8起辅助作用,第一信号使T 细胞初步活化,代表适应性免疫应答严格的特异性。第二信号(或共刺激信号)则由APC或靶细胞表面的共刺激分子与T细胞表面的相应的共刺激分子相互作用而产生。共刺激信号使T 细胞完全活化,只有完全活化的T细胞才能进一步分泌细胞因子和表达细胞因子受体,在细胞因子的作用下分化和增殖。没有共刺激信号,T细胞不能活化而克隆失能。
(1)CD28:CD28产生的共刺激信号在T 细胞活化中发挥重要作用:诱导T细胞表达抗细胞凋亡蛋白(Bcl-XL等),防止细胞调亡;刺激T细胞合成IL-2等细胞因子,促进T细胞的增殖和分化。
(2)CTLA-4(CD152):CTLA-4表达于活化的CD4+和CD8+T细胞,其配体亦是CD80和CD86,但CTLA-4与配体结合的亲和力显著高于CD28。
(3)ICOS:ICOS (inducible co-stimulator)表达于活化T细胞,配体为ICOSL。
(4)PD-1:PD-1(programmed death 1)表达于活化T细胞,配体为PD-L1和PD-L2。PD-1与配体结合后,可抑制T细胞的增殖以及IL-2和IFN-γ等细胞因子的产生,并抑制B细胞的增殖、分化和Ig的分泌。
(5)CD2:CD2又称淋巴细胞功能相关抗原2(LFA-2),配体为LFA-3(CD58)或CD48(小鼠和大鼠)。CD2表达于95%成熟T细胞、50% ~70%胸腺细胞以及部分NK细胞,除介导T细胞与APC或靶细胞之间的黏附外,还为T细胞提供活化信号。
(6)CD40L:即CD40配体(CD154),是表达于活化CD4+T细胞和部分CD8+T细胞表面的协同刺激分子,能与B细胞表面CD40分子结合。
4.丝裂原受体及其他表面分子T细胞还表达多种丝裂原(mitogen)受体,丝裂原可非特异性直接诱导静息T细胞活化和增殖。刀豆蛋白A(concanavalin A,ConA)和植物血凝素(phytohemagglutinin,PHA)是最常用的T细胞丝裂原。商陆丝裂原(pokeweedmitogen,PWM)除诱导T细胞活化外,还可以诱导B细胞的活化。T细胞活化后还表达许多与效应功能有关的分子。例如,与其活化、增殖和分化密切相关的细胞因子受体(IL-1R、IL-2RIL-4R、IL-6R、IL-7R、IL-12R、IFN-γR和趋化因子受体等)及可诱导细胞凋亡的FasL(CD95L)等。
T细胞也表达Fc受体(如FcγR等)和补体受体(CR1)等。
(三)T细胞的分类和功能
T细胞具有高度的异质性,按照不同的分类方法,T细胞可分为若干亚群,各亚群之间相互调节,共同发挥其免疫学功能。
1.根据所处的活化阶段分类
(1)初始T细胞:初始T细胞(naive Tcell)是指从未接受过抗原刺激的成熟T细胞,存活期短,表达CD45RA和高水平的L-选择素(CD62L),参与淋巴细胞再循环,主要功能是识别抗原。
(2)效应T细胞:效应T细胞存活期短,除表达高水平的高亲和力IL-2受体外,还表达整合素,是行使免疫效应的主要细胞。效应性T细胞主要是向外周炎症部位或某些器官组织迁移,并不再循环至淋巴结。
(3)记忆T细胞:记忆T细胞存活期长,可达数年。接受相同抗原刺激后可迅速活化,并分化为效应性T细胞,介导再次免疫应答。
2.根据TCR类型的分类 根据TCR类型,T细胞可分为表达TCRαβ的T细胞和表达TCRγδ的T细胞,分别简称为αβT细胞和γδT细胞。
3.根据CD分子分亚群 根据是否表达CD4或CD8,T细胞分为CD4+T细胞和CD8+T细胞。
(1)CD4+T细胞:CD4表达于60%~65%T细胞及部分NKT细胞,巨噬细胞和树突状细胞亦可表达CD4,但表达水平较低。CD4+T细胞识别由13~17个氨基酸残基组成的抗原肽,受自身MHCHⅡ类分子的限制,活化后,分化为Th细胞,但也有少数CD4+效应T细胞具有细胞毒作用和免疫抑制作用。
(2)CD8+T细胞:CD8表达于30%~35%T细胞。CD8+T细胞识别由8~10个氨基酸残基组成的抗原肽,受自身MHCⅠ类分子的限制,活化后,分化为细胞毒性T细胞(CTL),具有细胞毒作用,可特异性杀伤靶细胞。
4.根据功能特征分亚群 根据功能的不同,T细胞可分为Th细胞、CTL和调节性T细胞。这些细胞实际上是初始CD4+T细胞或初始CD8+T细胞活化后分化成的效应细胞。
(1)辅助性T细胞(helper T cell,Th):Th均表达CD4,通常所称的CD4+T细胞即指Th。未受抗原刺激的初始CD4+T细胞为Th0。Th0向不同谱系的分化受抗原的性质和细胞因子等因素的调控,而最重要的影响因素是细胞因子的种类和细胞因子之间的平衡(图7-5)。例如,胞内病原体和肿瘤抗原以及IL-12、IFN-γ诱导Th0向Thl分化,其中IL-12主要由APC产生。普通细菌和可溶性抗原以及IL-4诱导Th0向Th2分化,其中IL-4主要由局部环境中NKT细胞以及嗜酸性粒细胞和嗜碱性粒细胞等所产生。
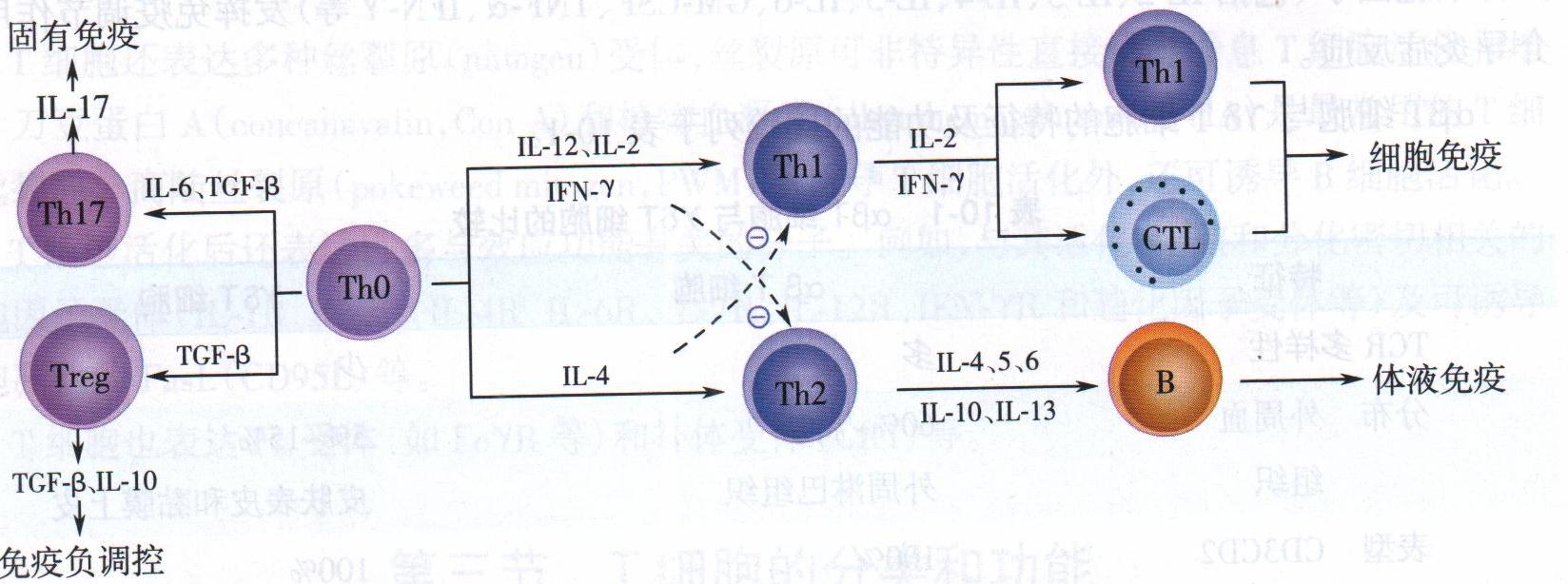
图 细胞因子对Th细胞亚群的调节作用
除细胞因子外,APC表达的共刺激分子对Th0的分化方向亦发挥调节作用。
1)Th1:主要分泌Th1型细胞因子,包括IFN-γ、TNF、IL-2等。它们能促进Th1的进一步增殖,进而发挥细胞免疫的效应,同时还能抑制Th2增殖。
2)Th2:主要分泌Th2型细胞因子,包括IL-4、IL-5、IL-10及 IL-13等。它们能促进Th2细胞增殖,进而辅助B细胞活化,发挥体液免疫的作用,同时抑制Th1增殖。
3)Th3:主要分泌大量TGF-β,起免疫抑制的作用,有人将其归入Treg的亚群。
4)Th17:通过分泌IL-17、IL-21、IL-22、IL-26、TNF-α等多种细胞因子参与固有免疫和某些炎症的发生,在免疫病理损伤,特别是自身免疫病的发生和发展中起重要作用。
(2)细胞毒性T细胞(cytotoxic T lymphocyte,CTL):CTL表达CD8,通常所称的CD8+T细胞即指CTL,而同样有细胞毒作用的γδT细胞和NKT细胞不属于CTL。CTL的主要功能是特异性识别内源性抗原肽-MHCⅠ类分子复合物,进而杀伤靶细胞(细胞内寄生病原体感染的细胞或肿瘤细胞)。杀伤机制主要有两种:一是分泌穿孔素、颗粒酶、颗粒溶素及淋巴毒素等物质直接杀伤靶细胞;二是通过Fas/FasL途径诱导靶细胞凋亡。
