6.2 阳离子聚合(Cation Polymerization)
反应通式:
![]()
![]() :阳离子活性中心,通常为碳阳离子(Carbo-cation)或氧翁离子。
:阳离子活性中心,通常为碳阳离子(Carbo-cation)或氧翁离子。
![]() :紧靠中心离子的引发剂碎片,称反离子(Counterion) 。
:紧靠中心离子的引发剂碎片,称反离子(Counterion) 。
1. 阳离子聚合的单体
烯类、羰基化合物、含氧杂环的单体能发生阳离子聚合。原则上,取代基为供电基团的单体能发生阳离子聚合。
●供电取代基使C=C电子云密度增加,有利于阳离子活性种进攻;
● 形成阳离子增长种后,供电取代基又使阳离子增长种电子云分散,能量降低而稳定。

(1) 异丁烯与α-烯烃
● 乙烯(Ethylene):无侧基,C=C电子云密度低,对质子亲和力小,难以阳离子聚合。
● 丙烯(Propylene)、丁烯(Butylene):烷基供电性弱,生成的二级碳阳离子较活泼,易发生重排等副反应,生成更稳定的三级碳阳离子。
●异丁烯(Isobutylene):同一C原子上两烷基供电基,C=C电子云密度增加很多,易受质子进攻,生成稳定的三级碳阳离子。
异丁烯是唯一能进行阳离子聚合的α-烯烃,且它只能进行阳离子聚合。常用异丁烯来判别阳离子聚合机理。
●更高级的α-烯烃:由于位阻效应,只能形成二聚体(Dimer)。
(2) 烷基乙烯基醚:分子结构中同时存在诱导效应与共轭效应,其中诱导效应的烷氧基使双键电子云密度降低;而共轭效应,氧原子上未共用电子对与C=C形成P~π共轭,使双键电子云密度增加。其中,共轭效应占主导,进行阳离子聚合。
(3)共轭单体- 苯乙烯、丁二烯、异戊二烯
π电子活动性强,易诱导极化,能进行阳离子聚合,但其活性不及异丁烯和烷基乙烯基醚。工业上很少单独用阳离子聚合生成均聚物。一般选用共聚单体。
异丁烯与少量异戊二烯共聚,制备丁基橡胶。

2. 阳离子聚合引发体系及引发作用
阳离子聚合的常用引发剂有两种类型,质子酸与Lewis酸。
(1) 质子酸
例如浓H2SO4、H3PO4、HClO4、CCl3COOH等强质子酸。
引发机理:在非水介质中离解成质子氢(H+),使烯烃质子化,引发单体进行阳离子聚合。
质子酸作为引发剂的条件有两个,一是有足够强度产生H+,二是酸根离子(反离子)的亲核性不能过强,以免与活性中心结合成共价键,使链终止。
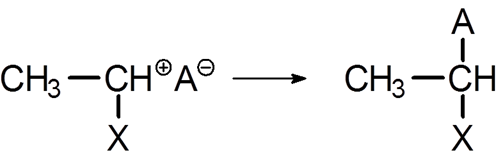
不同质子酸的酸根的亲核性不同,氢卤酸的X-亲核性太强,不能作为阳离子聚合引发剂,如HCl引发异丁烯 。

(2) Lewis酸,如BF3、AlCl3、 TiCl4、SnCl4、ZnCl2等
这些引发剂单独使用活性较低,需添加少量共引发剂,共引发剂 (co-initiator) ,质子供体或碳阳离子供给体。
(a)质子给体是一类在Lewis酸存在下能析出质子的物质,如水、卤化氢、醇、有机酸等;以 BF3和 H2O引发体系为例:
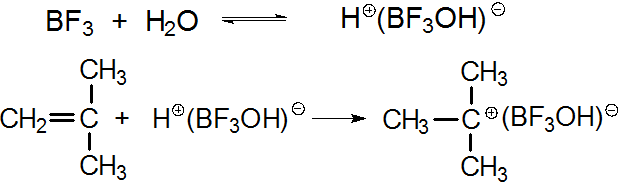
必须注意,作为引发剂的质子给体如水、醇等的用量必须严格控制,过量会使聚合变慢甚至无法进行,并导致分子量下降。究其原因,一是使Lewis酸毒化失活,以水为例: 
(b)正碳离子给体是一些在Lewis酸的活化下能产生碳阳离子的化合物:三级(或苄基)卤代烃、醚、醇、酯等,在Lewis酸的活化下产生碳阳离子引发聚合反应。
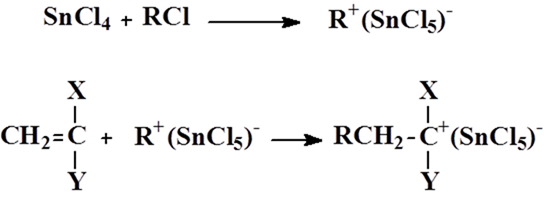
引发活性取决于向单体提供质子氢或R+的能力,引发剂和共引发剂的不同组合,得到不同的引发活性。主引发剂的活性与其接受电子的能力和酸性强弱有关。
活性次序:BF3 > AlCl3 > TiCl4> SnCl4
AlCl3 > AlRCl2 > AlR2Cl > AlR3
共引发剂,活性次序一般也即其酸性强弱次序。
例如异丁烯以BF3为引发剂时,共引发剂的活性比为水: 醋酸: 甲醇=50 : 1.5 : 1。
通常引发剂和共引发剂有一最佳比,此时聚合速率最快,分子量最大。最佳比还与溶剂性质有关。共引发剂过量可能生成氧鎓离子,其活性低于络合的质子酸,使聚合速率降低。
![]()
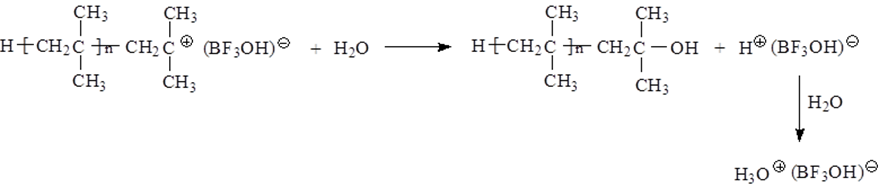
形成的氧鎓离子活性低,不能再引发聚合。
(c)其他引发剂
其它阳离子引发剂有碘、氧鎓离子及阳离子盐,如高氯酸盐(ClO4)-、三苯基甲基盐等。这些比较稳定的阳离子盐只能引发N-乙烯基咔唑、对甲氧基苯乙烯、乙烯基醚等高活性单体,而不能引发异丁烯或苯乙烯。
如碘分子歧化成离子对,再引发聚合:![]()
形成的碘阳离子可引发活性较大的单体,如对甲氧基苯乙烯、烷基乙烯基醚等。
3. 阳离子聚合机理
(1) 链引发:主引发剂与共引发剂形成络合物离子对;
![]()
C、RH分别为主引发剂和共引发剂;M为单体。
络合离子对与单体双键加成形成单体碳阳离子
![]()
阳离子聚合的引发反应特点是引发速率快,引发活化能为Ei=8.4-21kJ/mol。
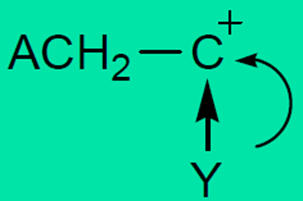
(2) 链增长:引发生成的碳阳离子活性中心与反离子形成离子对,单体分子不断插入其中而增长。
![]()
链增长反应的特点是增长是离子与分子间反应,速度快,活化能低;中心阳离子与反离子形成离子对,对单体单元的构型有一定的控制能力,但远不如阴离子与配位聚合;增长过程中伴有分子内重排反应、转移与异构化。
(3) 链转移和链终止:由于增长活性中心带有相同电荷,不能双基终止。往往通过链转移终止。


