6 离子聚合反应

6.1 阴离子聚合(Anionic polymerization)
反应通式:![]()

1、阴离子聚合的烯类单体
烯类、羰基化合物、含氧三元杂环以及含氮杂环的单体,其中带有吸电子取代基的烯类单体是本章研究的对象。
吸电子取代基的主要作用有两个,一是吸电子基能使C=C上的电子云密度降低,有利于阳离子的进攻;二是吸电子基也使碳阴离子增长种的电子云密度分散,能量降低而稳定。
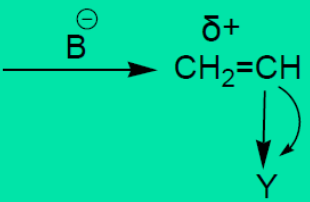
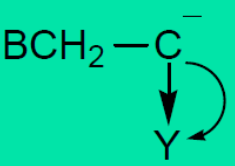
具有π-π共轭体系的烯类单体才能进行阴离子聚合,如苯乙烯、丙烯酸酯类等。VC、VAc等单体,P-π共轭效应与诱导效应相反,减弱了双键电子云密度下降的程度,不利于阴离子聚合。环氧乙烷、环氧丙烷、己内酰胺等杂环化合物,可由阴离子催化剂开环聚合。
2.阴离子聚合的引发剂与引发反应
阴离子聚合反应的引发剂主要是电子给体,即亲核试剂。按引发机理分为:电子转移引发, 如碱金属、碱金属芳烃引发剂;阴离子引发,如有机金属化合物。
1)电子转移引发
电子转移型引发剂主要是碱金属(Alkali metal),例如Li、Na、K等。其中又可分为电子直接转移引发,碱金属将最外层的一价电子直接转移给单体,生成自由基-阴离子,自由基阴离子末端很快偶合终止,生成双阴离子,两端阴离子同时引发单体聚合。如丁钠橡胶的生产。
![]()
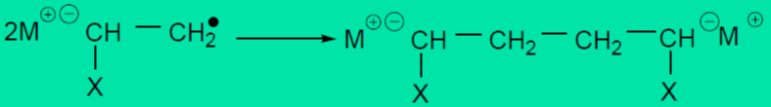
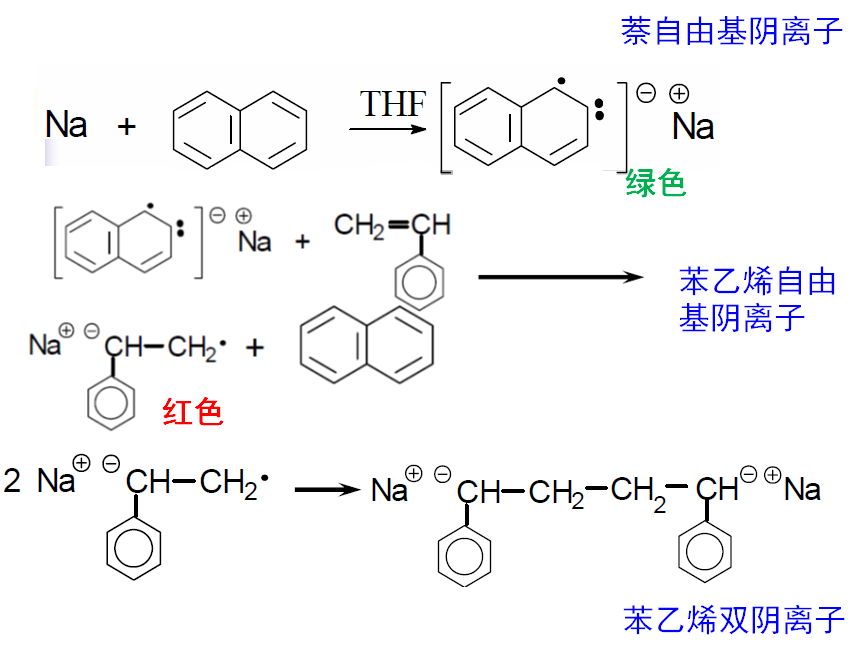
另一种是电子间接转移引发,碱金属—芳烃复合引发剂,碱金属(如钠)将最外层的一个价电子转移给中间体(如萘),使中间体变为自由基阴离子(如萘钠络合物),再引发单体聚合,同样形成双阴离子。
典例:钠和萘在四氢呋喃(THF)中引发苯乙烯聚合。四氢呋喃的作用是将氧上的未共用电子对与钠离子形成较稳定的络合阳离子,使萘钠结合疏松,更有利于萘自由基阴离子的引发。
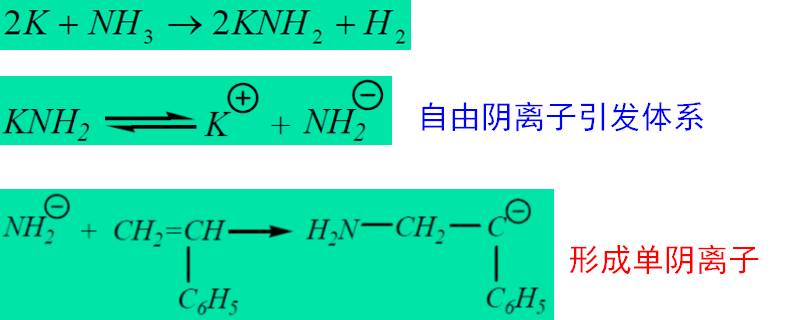
2)阴离子引发-有机金属化合物
有机金属化合物:最常用的阴离子聚合引发剂如金属氨基化合物、金属烷基化合物等。以金属氨基化合物的引发为例:
最常用的阴离子聚合引发剂是金属烷基化合物,其中丁基锂(Butyllithium,C4H9-Li)是最常见的阴离子聚合引发剂之一,它以离子对的形式引发丁二烯、异戊二烯聚合。
ROH,H2O ,R3P,R3N等中性亲核试剂,都有未共用电子对,能引发很活泼的单体阴离子聚合,如硝基乙烯、偏二腈乙烯、α-氰基丙烯酸酯等。
3)阴离子活性聚合的机理与应用(Living polymerization)
阴离子聚合只有引发和增长两步基元反应,不存在真正的链终止和链转移反应。
阴离子聚合无终止的主要原因:●活性链上脱负氢离子困难;●反离子一般为金属阳离子,无法从其中夺取某个原子或H+而终 止。● 如要发生向单体的转移,则要从活性链上脱去负氢原子H-,能量很高。向反离子转移也要脱去负氢原子,因此不易发生。
活性聚合的应用
(1)制备遥爪聚合物,遥爪聚合物指
指分子链两端都带有活性官能团的聚合物,两个官能团遥遥位居于分子链的两端,象两个爪子,故称为遥爪聚合物。制备方法:聚合末期在活性链上加入如CO2、环氧乙烷、二异氰酸酯等添加剂,使末端带羧基、羟基、氨基等基团的聚合物,合成遥爪聚合物。
(2)制备嵌段共聚物
先制成一种单体的“活的聚合物”,再加另一单体共聚,制得任意链段长度的嵌段共聚物。如合成SBS热塑性橡胶。
3 活性阴离子聚合动力学
1)聚合速率
阴离子聚合反应速率用增长速率Rp来表示。

[M-]:阴离子增长活性中心的总浓度。在聚合全过程中保持不变,且等于引发剂浓度(如萘钠的浓度)。
[C]:引发剂浓度


