1 绪论
1.5 大分子微结构
高分子链的微结构复杂,在高分子链中,结构单元的化学组成相同时,连接方式和空间排列也会不同。由于结构单元键接方式的序列结构、由于结构单元在空间排布的立体构型等。
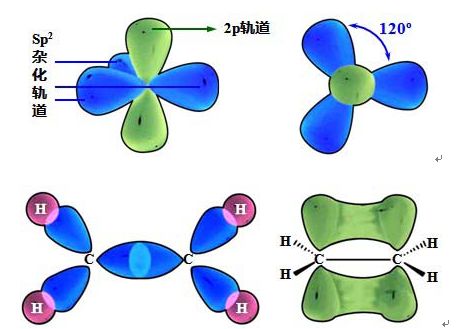
高分子链的连接方式和空间排列之所以不同,都来自于烯烃的SP2杂化结构所致。π键垂直于由四个C-H和一个C-C σ键所构成的平面,这样活性中心-自由基可以从平面的上下两个方向进攻p电子,两种进攻的几率基本一致,除非烯烃带有的取代基体积过大。这就会造成空间排列的不同,使聚合物出现立体异构与几何异构两种异构化现象。
(1)序列异构
具有取代基的乙烯基单体可能存在头-尾或头-头或尾-尾连接。
![]()
头-尾结构 头-头、尾-尾结构
(2)立体异构
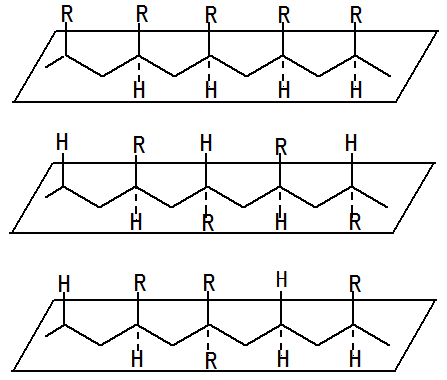
由于C=C双键是SP2杂化,使其处于平面结构,当双键带有取代基时,取代基在平面上下两侧的排列方式不同时,会出现全同立构、间同立构和无规立构三种排列方式。
(3)几何构型
大分子链中存在双键时,会存在几何构型。大取代基位于双键的同一侧时为顺式结构,位于双键的两侧时是反式结构。
1.6 线形、支链形和交联大分子
高分子链的几何形状大致有三种,即线形、支链形和体型。
线形高分子,其长链可能比较伸展,也可能卷曲成团,取决于链的柔顺性和外部条件,一般为无规线团。适当溶剂可溶解,加热可以熔融,即可溶可熔。
支链高分子,线形高分子上带有侧枝, 侧枝的长短和数量可不同,高分子上的支链,有的是聚合中自然形成的;有的则是人为的通过反应接枝上去的。支链高分子可溶解在适当溶剂中, 加热可以熔融,即可溶可熔。
体形高分子,可看成是线形或支链形大分子间以化学键交联而成,许多大分子键合成一个整体,已无单个大分子可言。交联程度浅的, 受热可软化,适当溶剂可溶胀,交联程度深的, 既不溶解, 又不熔融,即不溶不熔。
1.7 高分子的聚集态结构
聚集态结构,分子通过次价键聚集在一起,形成了特定聚集态结构:固态、液态和气态。高分子分子量大,分子间的作用力也大,因此只有固态和液态两种。
固态聚合物通常有两种状态,即结晶态(crystalline)和无定形态(amorphous)。
液态聚合物只有一种状态即粘流态(viscous state),如果聚合物的熔融温度超过其分解温度时,聚合物虽然有粘流态,但是通常是无法熔化的,例如聚丙烯腈、聚四氟乙烯等。
1)结晶态
高分子可以结晶,但不能达到100%,即结晶高分子多处于晶态和非晶态两相共存状态。
高分子结晶能力与内因(大分子的结构规整性、分子柔性和分子间力)和外因(取向、温度等)有关。
熔融温度或称熔点(Tm)是结晶高分子的热转变温度。由于高分子结晶存在缺陷,并有分子量分布等原因,结晶高分子的熔点通常有一范围。
线形聚乙烯分子结构简单规整,易紧密排列成结晶,结晶度可高达90%以上;带支链的聚乙烯结晶度就低得多(55%-65%);聚四氟乙烯结构与聚乙烯相似,结构对称,结晶度高。
2)无定形态(非晶态)
非晶态高分子的分子链处于无规线团状态。这种缠结、混杂的状态也可能存在着一定程度的有序性。
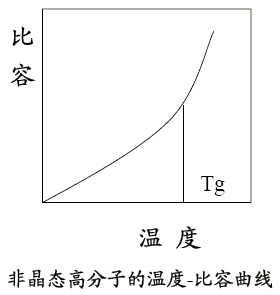
非晶态高分子没有熔点,在比容-温度曲线上有一转折点,此点对应的温度称为玻璃化转变温度,用Tg表示。它代表链段能够运动或主链中价键能扭转的温度。高分子可以是完全的非晶态。


