-
1 生物分子的结构与功能
-
2
氨基酸和蛋白质
组成蛋白质的20种氨基酸的分类
1、非极性氨基酸
包括:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸
2、极性氨基酸
极性中性氨基酸:色氨酸、酪氨酸、丝氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸
酸性氨基酸:天冬氨酸、谷氨酸
碱性氨基酸:赖氨酸、精氨酸、组氨酸
其中:属于芳香族氨基酸的是:色氨酸、酪氨酸、苯丙氨酸
属于亚氨基酸的是:脯氨酸
含硫氨基酸包括:半胱氨酸、蛋氨酸
氨基酸的理化性质
1、两性解离及等电点
氨基酸分子中有游离的氨基和游离的羧基,能与酸或碱类物质结合成盐,故它是一种两性电解质。在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。
2、氨基酸的紫外吸收性质
芳香族氨基酸在280nm波长附近有最大的紫外吸收峰,由于大多数蛋白质含有这些氨基酸残基,氨基酸残基数与蛋白质含量成正比,故通过对280nm波长的紫外吸光度的测量可对蛋白质溶液进行定量分析。
3、茚三酮反应
氨基酸的氨基与茚三酮水合物反应可生成蓝紫色化合物,此化合物最大吸收峰在570nm波长处。由于此吸收峰值的大小与氨基酸释放出的氨量成正比,因此可作为氨基酸定量分析方法。
肽
两分子氨基酸可借一分子所含的氨基与另一分子所带的羧基脱去1分子水缩合成最简单的二肽。二肽中游离的氨基和羧基继续借脱水作用缩合连成多肽。10个以内氨基酸连接而成多肽称为寡肽;39个氨基酸残基组成的促肾上腺皮质激素称为多肽;51个氨基酸残基组成的胰岛素归为蛋白质。
多肽连中的自由氨基末端称为N端,自由羧基末端称为C端,命名从N端指向C端。
人体内存在许多具有生物活性的肽,重要的有:
谷胱甘肽(GSH):是由谷、半胱和甘氨酸组成的三肽。半胱氨酸的巯基是该化合物的主要功能基团。GSH的巯基具有还原性,可作为体内重要的还原剂保护体内蛋白质或酶分子中巯基免被氧化,使蛋白质或酶处于活性状态。

蛋白质的分子结构
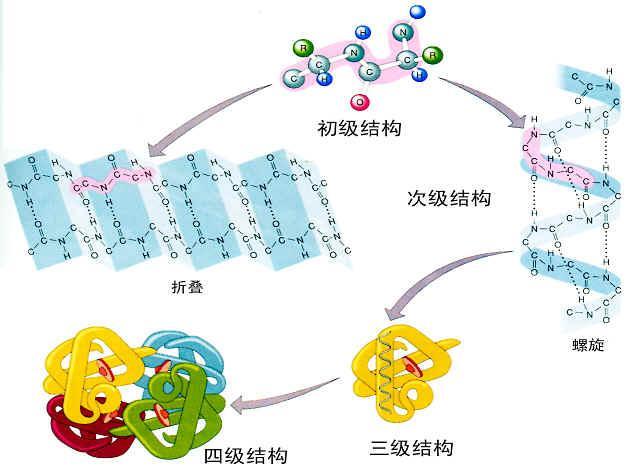
1、蛋白质的一级结构:即蛋白质分子中氨基酸的排列顺序。
主要化学键:肽键,有些蛋白质还包含二硫键。
2、蛋白质的高级结构:包括二级、三级、四级结构。
1)蛋白质的二级结构:指蛋白质分子中某一段肽链的局部空间结构,也就是该段肽链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。二级结构以一级结构为基础,多为短距离效应。可分为:
α-螺旋:多肽链主链围绕中心轴呈有规律地螺旋式上升,顺时钟走向,即右手螺旋,每隔3.6个氨基酸残基上升一圈,螺距为0.540nm。α-螺旋的每个肽键的N-H和第四个肽键的羧基氧形成氢键,氢键的方向与螺旋长轴基本平形。
β-折叠:多肽链充分伸展,各肽键平面折叠成锯齿状结构,侧链R基团交错位于锯齿状结构上下方;它们之间靠链间肽键羧基上的氧和亚氨基上的氢形成氢键维系构象稳定.
β-转角:常发生于肽链进行180度回折时的转角上,常有4个氨基酸残基组成,第二个残基常为脯氨酸。
无规卷曲:无确定规律性的那段肽链。
主要化学键:氢键。
2)蛋白质的三级结构:指整条肽链中全部氨基酸残基的相对空间位置,显示为长距离效应。
主要化学键:疏水键(最主要)、盐键、二硫键、氢键、范德华力。
3)蛋白质的四级结构:对蛋白质分子的二、三级结构而言,只涉及一条多肽链卷曲而成的蛋白质。在体内有许多蛋白质分子含有二条或多条肽链,每一条多肽链都有其完整的三级结构,称为蛋白质的亚基,亚基与亚基之间呈特定的三维空间排布,并以非共价键相连接。这种蛋白质分子中各个亚基的空间排布及亚基接触部位的布局和相互作用,为四级结构。由一条肽链形成的蛋白质没有四级结构。
主要化学键:疏水键、氢键、离子键
核酸的结构与功能
核酸的分子组成
基本组成单位是核苷酸,而核苷酸则由碱基、戊糖和磷酸三种成分连接而成。
两类核酸:脱氧核糖核酸(DNA),存在于细胞核和线粒体内。
核糖核酸(RNA),存在于细胞质和细胞核内。
1、碱基:嘌呤和嘧啶环中均含有共轭双键,因此对波长260nm左右的紫外光有较强吸收,这一重要的理化性质被用于对核酸、核苷酸、核苷及碱基进行定性定量分析。
2、戊糖:DNA分子的核苷酸的 糖是β-D-2-脱氧核糖,RNA中为β-D-核糖。
3、磷酸:生物体内多数核苷酸的磷酸基团位于核糖的第五位碳原子上。
核酸的一级结构
核苷酸在多肽链上的排列顺序为核酸的一级结构,核苷酸之间通过3′,5′磷酸二酯键连接。
DNA的空间结构与功能
1、DNA的二级结构
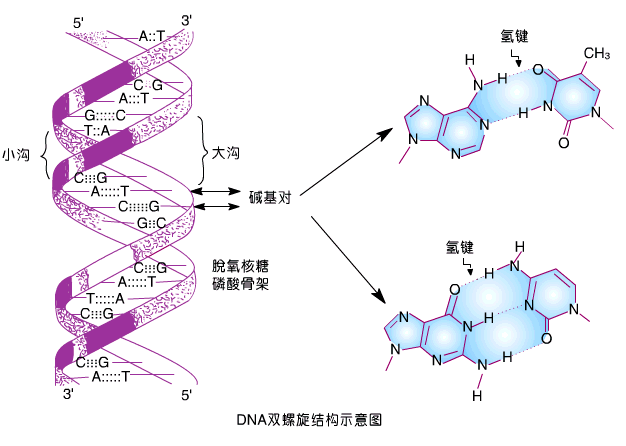
DNA双螺旋结构是核酸的二级结构。双螺旋的骨架由糖和磷酸基构成,两股链之间的碱基互补配对,是遗传信息传递者,DNA半保留复制的基础,结构要点:
a.DNA是一反向平行的互补双链结构 亲水的脱氧核糖基和磷酸基骨架位于双链的外侧,而碱基位于内侧,碱基之间以氢键相结合,其中,腺嘌呤始终与胸腺嘧啶配对,形成两个氢键,鸟嘌呤始终与胞嘧啶配对,形成三个氢键。
b.DNA是右手螺旋结构 螺旋直径为2nm。每旋转一周包含了10个碱基,每个碱基的旋转角度为36度。螺距为3.4nm,每个碱基平面之间的距离为0.34nm。
c.DNA双螺旋结构稳定的维系 横向靠互补碱基的氢键维系,纵向则靠碱基平面间的疏水性堆积力维持,尤以后者为重要。
2、DNA的三级结构
三级结构是在双螺旋基础上进一步扭曲形成超螺旋,使体积压缩。在真核生物细胞核内,DNA三级结构与一组组蛋白共同组成核小体。在核小体的基础上,DNA链经反复折叠形成染色体。
3、功能
DNA的基本功能就是作为生物遗传信息复制的模板和基因转录的模板,它是生命遗传繁殖的物质基础,也是个体生命活动的基础。
DNA中的核糖和磷酸构成的分子骨架是没有差别的,不同区段的DNA分子只是碱基的排列顺序不同。
RNA的空间结构与功能
DNA是遗传信息的载体,而遗传作用是由蛋白质功能来体现的,在两者之间RNA起着中介作用。其种类繁多,分子较小,一般以单链存在,可有局部二级结构,各类RNA在遗传信息表达为氨基酸序列过程中发挥不同作用。如:
名 称 功 能
核蛋白体RNA (rRNA)核蛋白体组成成分
信使RNA (mRNA)蛋白质合成模板
转运RNA (tRNA)转运氨基酸
不均一核RNA (HnRNA)成熟mRNA的前体
小核RNA (SnRNA)参与HnRNA的剪接、转运
小核仁RNA (SnoRNA)rRNA的加工和修饰
1、信使RNA(半衰期最短)
1)hnRNA为mRNA的初级产物,经过剪接切除内含子,拼接外显子,成为成熟的mRNA并移位到细胞质
2)大多数的真核mRNA在转录后5′末端加上一个7-甲基鸟嘌呤及三磷酸鸟苷帽子,帽子结构在mRNA作为模板翻译成蛋白质的过程中具有促进核蛋白体与mRNA的结合,加速翻译起始速度的作用,同时可以增强mRNA的稳定性。3′末端多了一个多聚腺苷酸尾巴,可能与mRNA从核内向胞质的转位及mRNA的稳定性有关。
3)功能是把核内DNA的碱基顺序,按照碱基互补的原则,抄录并转送至胞质,以决定蛋白质合成的氨基酸排列顺序。mRNA分子上每3个核苷酸为一组,决定肽链上某一个氨基酸,为三联体密码。
2、转运RNA(分子量最小)
1)tRNA分子中含有10%~20%稀有碱基,包括双氢尿嘧啶,假尿嘧啶和甲基化的嘌呤等。
2)二级结构为三叶草形,位于左右两侧的环状结构分别称为DHU环和Tψ环,位于下方的环叫作反密码环。反密码环中间的3个碱基为反密码子,与mRNA上相应的三联体密码子形成碱基互补。所有tRNA3′末端均有相同的CCA-OH结构。
3)三级结构为倒L型。
4)功能是在细胞蛋白质合成过程中作为各种氨基酸的戴本并将其转呈给mRNA。
3、核蛋白体RNA(含量最多)
1)原核生物的rRNA的小亚基为16S,大亚基为5S、23S;真核生物的rRNA的小亚基为18S,大亚基为5S、5.8S、28S。真核生物的18SrRNA的二级结构呈花状。
2)rRNA与核糖体蛋白共同构成核糖体,它是蛋白质合成机器--核蛋白体的组成成分,参与蛋白质的合成。
4、核酶
某些RNA 分子本身具有自我催化能,可以完成rRNA的剪接。这种具有催化作用的RNA称为核酶。
酶
酶的组成
单纯酶:仅由氨基酸残基构成的酶。
结合酶:酶蛋白:决定反应的特异性;
辅助因子:决定反应的种类与性质;可以为金属离子或小分子有机化合物。
可分为辅酶:与酶蛋白结合疏松,可以用透析或超滤方法除去。
辅基:与酶蛋白结合紧密,不能用透析或超滤方法除去。
酶蛋白与辅助因子结合形成的复合物称为全酶,只有全酶才有催化作用。
参与组成辅酶的维生素
转移的基团 辅酶或辅基所含维生素
氢原子NAD+﹑NADP+尼克酰胺(维生素PP)
FMN﹑FAD维生素B2
醛基TPP维生素B1
酰基辅酶A﹑硫辛酸泛酸、硫辛酸
烷基钴胺类辅酶类维生素B12
二氧化碳生物素生物素
氨基磷酸吡哆醛吡哆醛(维生素B6)
甲基、等一碳单位四氢叶酸叶酸

酶的活性中心
酶的活性中心由酶作用的必需基团组成,这些必需基团在空间位置上接近组成特定的空间结构,能与底物特异地结合并将底物转化为产物。对结合酶来说,辅助因子参与酶活性中心的组成。但有一些必需基团并不参加活性中心的组成。



